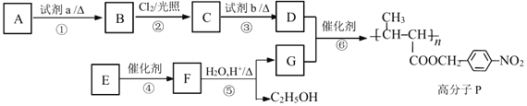
题目内容
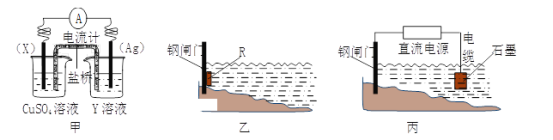
【题目】(1)依据反应:2Ag+(aq)+Cu(s)![]() Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。
Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。
①电极X的材料是___________;Y溶液可以是____________;
②银电极上发生的电极反应式是_________________________。
③在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是______(填离子符号)。
(2)金属腐蚀一般可分为化学腐蚀和电化学腐蚀,可以采用电化学手段进行防腐。
①炒菜的铁锅未及时清洗容易生锈。写出铁锅生锈过程的正极反应式__________________。
②为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用___________(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
③图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的_______极。
(3)蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O![]() Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。
①若此蓄电池放电时,该电池某一电极发生还原反应的物质是____(填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
②该电池放电时,正极附近溶液的PH_________(填增大、减小、不变)
③充电时该电池阳极的电极反应式________________。
【答案】Cu AgNO3 Ag++e-=Ag Cl- O2+2H2O+4e-=4OH- C 负 A 增大 Ni(OH)2-2e-+2OH-=NiO2+2H2O
【解析】
(1)由反应方程式可知,该原电池的电极反应式为:正极:2Ag++2e-═2Ag,负极:Cu-2e-═Cu2+,所以X极的材料应为Cu,电解质溶液Y应为AgNO3溶液,外电路中的电子从Cu极流向Ag极.盐桥中的K+移向正极(Ag极);NO3-移向负极(Cu极),以此解答。
(2)①生铁的吸氧腐蚀中,负极上铁失电子发生氧化反应,正极上是氧气得电子的还原反应;
②原电池的负极金属易被腐蚀,根据原电池的工作原理来回答;
③在电解池的阴极上的金属被保护,根据电解池的工作原理来回答;
(3)①依据电池反应分析,充电为电解池,放电为原电池;放电过程中原电池的负极上失电子发生氧化反应,正极上发生还原反应;
②放电时的电极反应是:负极:Fe-2e-+2OH-=Fe(OH)2;
③放电时正极发生还原反应,正极反应式为:NiO2+2e-+2H2O=Ni(OH)2+2OH-,充电时该电极发生氧化反应,是该电极反应的逆反应.
(1)①由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3;
②正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,故答案为: Ag++e-=Ag;
③盐桥中的阳离子移向正极,阴离子移向负极,Cl-移向负极向CuSO4溶液一端扩散,故答案为:Cl-;
(2)①炒过菜的铁锅未及时清洗容易发生电化学腐蚀而生锈,在铁的吸氧腐蚀中,负极上铁失电子发生氧化反应,Fe=Fe2+2e-,正极上是氧气得电子的还原反应,O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②为了降低某水库的铁闸门被腐蚀的速率,可以让金属铁做原电池的正极,其中焊接在铁闸门上的固体材料R可以是比金属铁的活泼性强的金属,钾钙钠都不能做电极材料,故答案为:C;
③电解池的阴极上的金属被保护,为降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的负极,故答案为:负;
(3)①根据原电池在放电时,负极发生氧化反应,正极发生还原反应,再根据元素化合价变化,可判断该电池负极发生反应的物质为Fe被氧化发生氧化反应,正极为NiO2,被还原发生还原反应,此电池为碱性电池,在书写电极反应和总电池反应方程式时不能出现H+,故放电时的电极反应是:负极:Fe-2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-,
故答案为:A;
②放电时的电极反应是:负极:Fe-2e-+2OH-=Fe(OH)2,所以pH增大,故答案为:增大;
③放电时正极发生还原反应,正极反应式为:NiO2+2e-+2H2O=Ni(OH)2+2OH-,充电时该电极发生氧化反应,是该电极反应的逆反应,电极反应式为:Ni(OH)2+2OH--2e-=NiO2+2H2O,故答案为:Ni(OH)2+2OH--2e-=NiO2+2H2O.

【题目】以菱锰矿![]() 主要成分
主要成分![]() ,还含有
,还含有![]() 、
、![]() 等杂质
等杂质![]() 为原料制备二氧化锰的工艺流程如下:
为原料制备二氧化锰的工艺流程如下:

已知部分金属离子开始沉淀及沉淀完全时的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时的pH |
|
|
|
|
沉淀完全时的pH |
|
|
|
|
(1)①“酸浸”时![]() 发生反应的离子方程式为________________________________________。
发生反应的离子方程式为________________________________________。
②“酸浸”过程中加入过量硫酸的目的除了加快酸浸的速率、_____________、___________。
③要提高“酸浸”的速率,还可以采取的方法是________________________________________。
(2)“氧化”时发生反应的离子方程式为________________________________________。
(3)“调pH”的目的是除去溶液中的杂质金属离子,“调pH”的范围应为_______________。
(4)当溶液中c(Al3+)≤10-5mol/L时,则认为![]() 沉淀完全,则
沉淀完全,则![]() ______________。
______________。
【题目】参考下列图表和有关要求回答问题:
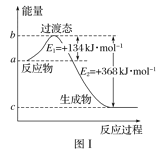
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:___。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | a | b | c | x |
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=___kJ·mol-1(用含有a、b、c、d的代数式表示)。