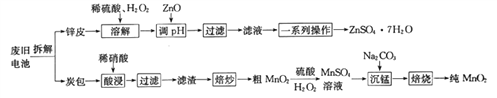
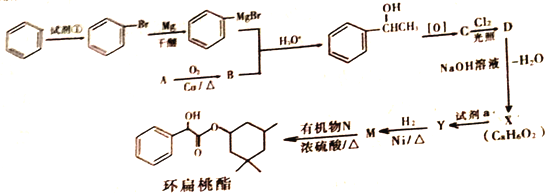
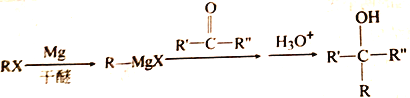题目内容
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法不正确的是

A. 电极a和电极c都发生氧化反应
B. 电极d的电极反应式为2H++2e-=H2↑
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 装置A中每消耗64gSO2,理论上装置A和装置B中均有2moH+通过质子交换膜
【答案】C
【解析】A装置能自发的进行氧化还原反应且没有外接电源,所以是原电池,a极上二氧化硫失电子为负极,b上氧气得电子为正极,B属于电解池,与电源的正极b相连的电极c为阳极,N2O4在阳极失电子生成N2O5,d为阴极,阴极上氢离子得电子生成氢气。A.电极a为负极,电极c为阳极,负极和阳极都发生氧化反应,故A正确;B.d为阴极,阴极上氢离子得电子生成氢气,电极d的电极反应式为2H++2e-=H2↑,故B正确;C.c为阳极,N2O4发生氧化反应生成N2O5,电极上的电极反应式为N2O4-2e-+ 2HNO3 =2N2O5+2H+,故C错误;D.装置A中每消耗64g SO2,即1mol,转移电子为2mol,由电荷守恒可知,理论上装置A和装置A中均有2mol H+通过质子交换膜和隔膜,故D正确;故选C。

练习册系列答案
相关题目