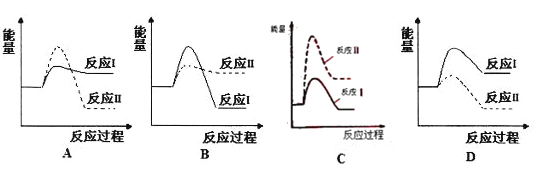
题目内容
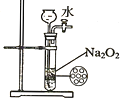
【题目】图 1 是课本“还原铁粉与水蒸气反应”的实验装置图。

(1)写出铁粉与水蒸气反应的化学方程式,并用“单线桥”标出电子转移方向及数目 :_____________;其中氧化剂为________________(写化学式);标况下,生成气体2.24L,则消耗Fe的质量为__________g。
(2)证明还原铁粉与水蒸气发生了反应的现象是: ________________。 若将反应生成的固体产物溶于盐酸,其离子反应方程式为________________。
【答案】![]() H2O 4.2 肥皂泡上升,点燃有爆鸣声 Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O
H2O 4.2 肥皂泡上升,点燃有爆鸣声 Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O
【解析】
(1)Fe与水蒸气高温下反应生成四氧化三铁和氢气,转移8e-,结合氧化还原反应的规律分析解答;
(2)氢气具有可燃性,四氧化三铁与盐酸反应生成氯化铁、氯化亚铁、水,据此分析解答。
(1)Fe与水蒸气高温下反应生成四氧化三铁和氢气,转移8e-,反应及电子转移方向及数目可以表示为![]() ,H元素的化合价降低,则H2O为氧化剂,生成4mol气体时消耗3molFe,则标况下,生成气体2.24L,则消耗Fe的质量为
,H元素的化合价降低,则H2O为氧化剂,生成4mol气体时消耗3molFe,则标况下,生成气体2.24L,则消耗Fe的质量为![]() ×
×![]() ×56g/mol=4.2g,故答案为:
×56g/mol=4.2g,故答案为:![]() ;H2O;4.2;
;H2O;4.2;
(2)还原铁粉与水蒸气发生了反应的现象是肥皂泡上升,点燃有爆鸣声,将反应生成的固体产物溶于盐酸,其离子反应方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O,故答案为:肥皂泡上升,点燃有爆鸣声;Fe3O4+8H+=Fe2++2Fe3++4H2O。

【题目】研究NOx、CO等大气污染气体的处理,对保护环境有重要的意义。回答下列问题:
(1)NOx与CO反应生成无污染气体的相关热化学方程式如下:①NO2(g)+CO(g)![]() CO2(g)+NO(g) ΔH1=234.0 kJ·mol1,②N2(g) +O2(g)
CO2(g)+NO(g) ΔH1=234.0 kJ·mol1,②N2(g) +O2(g)![]() 2NO(g)ΔH2=+179.5 kJ·mol1,③2NO(g)+O2(g)
2NO(g)ΔH2=+179.5 kJ·mol1,③2NO(g)+O2(g)![]() 2NO2(g) ΔH3=112.3 kJ·mol1,反应2NO2(g) +4CO(g)
2NO2(g) ΔH3=112.3 kJ·mol1,反应2NO2(g) +4CO(g)![]() N2(g)+4CO2(g)的ΔH=__________ kJ·mol1。
N2(g)+4CO2(g)的ΔH=__________ kJ·mol1。
(2)在一定温度下,向2 L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化剂作用下发生反应:2NO2(g)+4CO(g)![]() N2(g) +4CO2(g),测得相关数据如下:
N2(g) +4CO2(g),测得相关数据如下:
0 min | 5 min | 10 min | 15 min | 20 min | |
c(NO2)/mol·L1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol·L1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①在0~10 min,用CO2的浓度变化表示的反应速率为______________。
②为使该反应的反应速率增大,下列措施中可采用的是________(填字母代号)。
a.减小压强 b.适当升高温度 c.增大CO的浓度 d.选择高效催化剂
(3)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
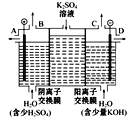
①该电解槽的阳极反应式为_______。此时通过阴离子交换膜的离子数____(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口____(填“A”“B”“C”或“D”)导出。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池负极的电极反应式为_____。