题目内容
【题目】氮、磷是生物体中不可缺少的元素,它们能形成多种化合物。

(1)基态氮原子的价层电子排布图为___________。
(2)NF3的键角小于NH3的原因是__________________。
(3)图1为硫、磷元素形成的一种分子,分子中每个原子最外层均达到8电子稳定结构。
①该化合物的分子式为______________,分子中硫原子的杂化轨道类型为____________________。
②磷的第一电离能大于硫的原因是________________________。
(4)PCl5中P—Cl键长有198pm和206 pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,阴离子的化学式为_________________。
(5)磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2所示。图中a点和c点的原子坐标参数依次为(0,0,0)、(1,![]() ,
,![]() ),则b点的原子坐标参数为_______________;已知该晶胞中距离最近的两个磷原子的核间距离为d nm,则该晶体密度为______g·cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
),则b点的原子坐标参数为_______________;已知该晶胞中距离最近的两个磷原子的核间距离为d nm,则该晶体密度为______g·cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
(6)某直链多磷酸钠的阴离子呈如图3所示的无限单链状结构,其中磷氧四面体通过共用顶角氧原子相连。则该多磷酸钠的化学式为________________。
【答案】![]() F的电负性大于H,故NF3中N周围的电子密度小于NH3中N周围的电子密度 P4S3 sp3 磷原子3p轨道处于半充满状态,不易失去电子 PCl6- (
F的电负性大于H,故NF3中N周围的电子密度小于NH3中N周围的电子密度 P4S3 sp3 磷原子3p轨道处于半充满状态,不易失去电子 PCl6- (![]() ,
,![]() ,
,![]() )
) ![]() NaPO3或(NaPO3)n
NaPO3或(NaPO3)n
【解析】
(1)基态氮原子的价电子排布式为2s22p3,结合泡利原理、洪特规则画出价电子排布图;
(2)从元素的电负性及电子云的密度大小及排斥作用力分析;
(3)①根据分子示意图,结合S、P原子最外层电子数及形成电子对数判断;从S原子具有的电子对数分析其杂化轨道类型;
②原子核外电子所处轨道为全满、半满或全空时体系能量低,稳定;
(4)根据正八面体、正四面体的构型分析其电离方式,从而判断微粒的结构;
(5)根据a、c点坐标参数可知,以晶胞a点为坐标原点建立空间直角坐标系,注意到b在该晶胞分成的8个立方体中的一个几何中心上,然后分析、判断;先计算每个晶胞中含有的P、B原子数,再计算晶胞的边长,最后根据![]() 计算晶胞的密度;
计算晶胞的密度;
(6) P原子周围有4个O原子,其中2个氧原子分别为2个四面体结构共用,每个P与3个O形成阴离子,且P的化合价为+5价,再计算阴离子化合价判断化学式。
(1)基态氮原子的价电子排布式为2s22p3,结合泡利原理、洪特规则画出价电子排布图为![]() ;
;
(2) NF3的键角小于NH3是由于F的电负性大于H,故NF3中N周围的电子密度小于NH3中N周围的电子密度,排斥作用减弱,故键角小;
(3)①P原子最外层有5个电子,达到8个电子的稳定结构要形成三对共用电子对;而S原子P原子最外层有6个电子,达到8个电子的稳定结构要形成两对共用电子对,所以图示中黑球表示P原子,白球表示S原子,该物质的分子式为P4S3;在P4S3分子中形成2个共键单键,且S上有2个孤电子对,因此P4S3分子中硫原子的杂化轨道类型为sp3杂化;
②P原子的3p电子处于该轨道的半充满的稳定状态,所以失去一个电子比电子不处于半满的稳定状态需要的能量高,因此磷的第一电离能大于硫;
(4) PCl5是非极性分子,可作为导电熔体,形成一种能导电的熔体,说明生成自由移动的阴阳离子,阴离子为正八面体,阳离子为正四面体,正四面体形阳离子为PCl4+、正六面体形阴离子是PCl6-,发生的电离反应式为:2PCl5=PCl4++PCl6-,故阴离子的化学式为PCl6-;
(5)由a、c两点的坐标参数可知:以晶胞a点为坐标原点建立空间直角坐标系,将该晶胞等分为8个小立方体,注意到b点在左下角靠近a点的小立方体的几何中心上,根据立体几何知识以及对称性,不难判断b的原子坐标在各个坐标轴上的分量为![]() ,所以其坐标参数为(
,所以其坐标参数为(![]() ,
,![]() ,
,![]() );在一个晶胞中含有的B原子数为4个,含有的P原子数为:8×
);在一个晶胞中含有的B原子数为4个,含有的P原子数为:8×![]() +6×
+6×![]() =4,晶胞的质量为m=
=4,晶胞的质量为m=![]() g,该晶胞中距离最近的两个磷原子的核间距离为d nm,处于晶胞面对角线一半的位置,所以晶胞的边长L=
g,该晶胞中距离最近的两个磷原子的核间距离为d nm,处于晶胞面对角线一半的位置,所以晶胞的边长L=![]() nm=
nm=![]() ×10-7cm,该晶胞的体积为V=L3=(
×10-7cm,该晶胞的体积为V=L3=(![]() ×10-7cm)3=
×10-7cm)3=![]() cm3,因此该晶胞的密度
cm3,因此该晶胞的密度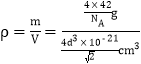 =
=![]() g/cm3;
g/cm3;
(6) P原子周围有4个O原子,其中2个氧原子分别为2个四面体结构共用,故每个P完全与3个O形成阴离子,且P的化合价为+5价,阴离子化合价为+5+3×(-2)= -1,故该该多磷酸钠的化学式为(NaPO3)n或写为NaPO3。

 阅读快车系列答案
阅读快车系列答案






