题目内容
【题目】制取Cl2的反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O ,回答下列问题:
(1)用双线桥法标出电子转移的方向和数目_____________。
(2)该反应中氧化剂与氧化产物物质的量之比是_____________。
(3)如反应中转移了2mol电子,则产生的Cl2在标准状况下体积为_____________L。
【答案】 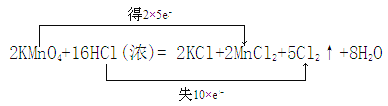 2:5 22.4L
2:5 22.4L
【解析】试题分析:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,锰元素化合价由+7降低为+2,氯元素化合价由-1升高为0;KMnO4是氧化剂、HCl是还原剂;反应中部分氯元素化合价发生变化,HCl表现还原性和酸性;根据方程式,生成5mol氯气,转移10mol电子。
解析:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,锰元素化合价由+7降低为+2,氯元素化合价由-1升高为0,用双线桥法表示电子转移的方向和数目为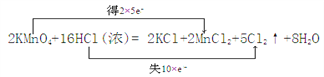 ;(2)锰元素化合价降低,氯元素化合价升高;KMnO4是氧化剂、HCl是还原剂,被氧化为Cl2,所以氧化剂与氧化产物物质的量之比是2:5;(3)根据方程式,生成5mol氯气,转移10mol电子,则转移2mol电子,生成1mol Cl2,标准状况下体积为
;(2)锰元素化合价降低,氯元素化合价升高;KMnO4是氧化剂、HCl是还原剂,被氧化为Cl2,所以氧化剂与氧化产物物质的量之比是2:5;(3)根据方程式,生成5mol氯气,转移10mol电子,则转移2mol电子,生成1mol Cl2,标准状况下体积为![]() 。
。

练习册系列答案
相关题目
【题目】元素周期表中前七周期元素种数如下:
周期序数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
请分析周期序数与元素种数的关系,然后预言第八周期最多可能含有的元素种数为( )
A. 18 B. 32 C. 50 D. 第64