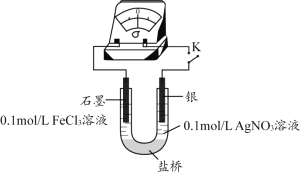
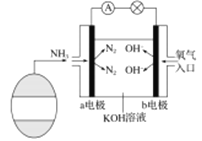
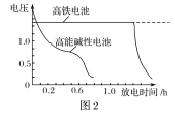
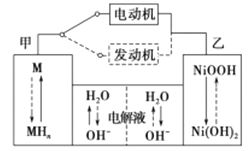
题目内容
【题目】以NA表示阿伏加德罗常数的值,下列说法正确的是( )
①1mol金属钠加热时完全反应,转移电子数为NA
②标准状况下,22.4L水中分子数为NA
③1L2mo/L的氯化镁溶液中含氯离子数目为4NA
④0.5molFe与足量稀HCl反应时,转移的电子数为2NA
⑤46gNO2和N2O4混合气体中含有原子数为3NA
A. ①③④⑤ B. ③④ C. ①③⑤ D. ①②③⑤
【答案】C
【解析】金属钠燃烧时化合价由0变为+1,所以1mol金属钠加热时完全反应,转移电子数为NA,故①正确;标准状况下,水是液体,故②错误;1L2mo/L的氯化镁溶液中含氯离子数目为![]() ,故③正确;Fe与足量稀HCl反应生成氯化亚铁和氢气,0.5molFe与足量稀HCl反应时,转移的电子数为NA,故④错误;NO2和N2O4的最简式是NO2,46gNO2和N2O4混合气体中含有原子数为
,故③正确;Fe与足量稀HCl反应生成氯化亚铁和氢气,0.5molFe与足量稀HCl反应时,转移的电子数为NA,故④错误;NO2和N2O4的最简式是NO2,46gNO2和N2O4混合气体中含有原子数为![]() 3NA,故⑤正确;故选C。
3NA,故⑤正确;故选C。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目