题目内容
【题目】铝、铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图其中能量最低的是___________(填字母),电子由状态B到状态C所得原子光谱为___________光谱(填“发射”或“吸收”),状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合__________________________。
A. ![]()
B. ![]()
C. ![]()
D. ![]()
(2)K3[Fe(CN)6]溶液可用于检验Fe2+,生成沉淀的离子方程式为______________________________。与CN- 互为等电子体的化合物是______(写名称)。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。与铜同一周期的副族元素的基态原子中,最外层电子数与铜原子相同的元素,其原子中未成对电子数为____。实验时形成的深蓝色溶液中的阳离子的结构简式为________。SO42-的立体构型为____,中心原子的杂化轨道类型为____。

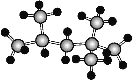
(4)某种Al-Fe合金的晶胞如图所示,若合金的密度为ρg·cm-3,则晶胞中Al与Fe的最小距离为___ pm。
【答案】A 吸收 泡利原理 2[Fe(CN)6] 3++3Fe2+=Fe[Fe(CN)6]2↓ 一氧化碳 6  正四面体形 sp3杂化
正四面体形 sp3杂化 
【解析】
(1)基态铝原子的电子排布式为1s22s22p63s23p1,因此能量最低的是选项A;电子由状态B到状态C需要吸收能量,所得原子光谱为吸收光谱,位于同一个轨道的2个电子自旋状态相反,根据状态D可知主要是不符合泡利原理。
(2)K3[Fe(CN)6]溶液可用于检验Fe2+,生成沉淀的离子方程式为2[Fe(CN)6]3++3Fe2+=Fe[Fe(CN)6]2↓。原子数和价电子数分别都相等的互为等电子体,与CN-互为等电子体的化合物是CO,名称是一氧化碳。
(3)与铜同一周期的副族元素的基态原子中,最外层电子数与铜原子相同的元素是Cr,其原子中未成对电子数为6。氨气和铜离子通过配位键形成阳离子,则实验时形成的深蓝色溶液中的阳离子的结构简式为 。SO42-中中心原子的价层电子对数是4且不含有孤对电子,其立体构型为正四面体形,中心原子的杂化轨道类型为sp3。
。SO42-中中心原子的价层电子对数是4且不含有孤对电子,其立体构型为正四面体形,中心原子的杂化轨道类型为sp3。
(4)根据晶胞结构可知晶胞含有4个Al和![]() 个Fe,若合金的密度为ρg·cm-3,则晶胞的边长是
个Fe,若合金的密度为ρg·cm-3,则晶胞的边长是 ,晶胞中Al与Fe的最小距离为体对角线的
,晶胞中Al与Fe的最小距离为体对角线的![]() ,即为
,即为 pm。
pm。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案