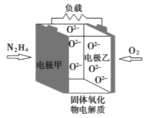
题目内容
【题目】下列叙述正确的是( )
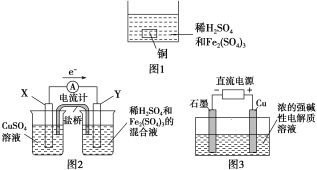
A. 如图1所示将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO![]() )为0.5 mol/L
)为0.5 mol/L
B. 如图2所示的装置中发生Cu+2Fe3+===Cu2++2Fe2+的反应,X极是负极,Y极的材料可以是铜
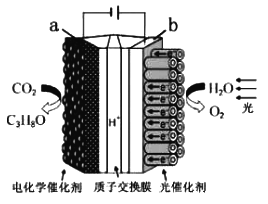
C. Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应
D. 如图3所示当有0.1 mol电子转移时,有0.1 mol Cu2O生成
【答案】A
【解析】
A.根据溶液中离子间存在电荷守恒原则计算;B.由电子转移方向可以知道X为负极,Y为正极,负极应为Cu;C.Cu被氧化生成Cu2O,应为电解池的阳极反应;D.根据电极方程式2Cu-2e-+2OH-=Cu2O+H2O 进行计算。
A.pH=1,则c(H+)=0.1 mol/L,由电荷守恒可以知道3c(Fe3+)+2c(Cu2+)+c(H+)+3c(Fe2+)=2c(SO![]() ),且溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,由Cu+2Fe3+===Cu2++2Fe2+可以知道, c(Fe2+)= 0.2 mol/L ,可计算得出c(SO
),且溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,由Cu+2Fe3+===Cu2++2Fe2+可以知道, c(Fe2+)= 0.2 mol/L ,可计算得出c(SO![]() )=0.5 mol/L ,A项正确;B.由电子转移方向可以知道X为负极,Y为正极,负极应为Cu,Y极的材料可以活泼性比铜弱的金属或非金属,故B错误;C.Cu被氧化生成Cu2O,应为电解池的阳极反应,发生氧化反应,故C错误;D.电极方程式为2Cu-2e-+2OH-=Cu2O+H2O,当有0.1 mol电子转移时,有0.05molCu2O生成,故D错误; 正确选项A。
)=0.5 mol/L ,A项正确;B.由电子转移方向可以知道X为负极,Y为正极,负极应为Cu,Y极的材料可以活泼性比铜弱的金属或非金属,故B错误;C.Cu被氧化生成Cu2O,应为电解池的阳极反应,发生氧化反应,故C错误;D.电极方程式为2Cu-2e-+2OH-=Cu2O+H2O,当有0.1 mol电子转移时,有0.05molCu2O生成,故D错误; 正确选项A。

【题目】在花瓶中加入“鲜花保鲜剂”可延长鲜花的寿命。下表是1 L“鲜花保鲜剂”的成分,阅读后并回答下列问题:
成分 | 质量/g | 摩尔质量/(g·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是__________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)__________________(只要求写表达式,不需计算)mol·L-1。
(3)下图所示的仪器中,在配制“鲜花保鲜剂”溶液时肯定不需要的是________(填字母),还缺少的玻璃仪器有__________________(填仪器名称)。
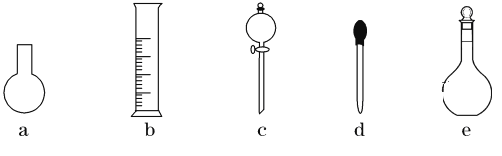
(4)配制过程中,下列操作对配制结果没有影响的是__________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中要含有__________。(填化学符号)
【题目】实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热。下图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略)。
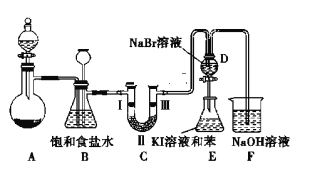
(1)装置B的作用是______ ,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:_______。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入______ (选“a”“b”或“c”)
a | b | c | |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E 的目的是为了比较Cl2、Br2、I2的氧化性强弱.已知Br2的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶于苯,且I2的苯溶液为紫红色.当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2,请写出D中对应的离子方程式并用单线桥法表示出电子转移情况:_________ 。打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象______ (填“能”或“不能”)说明 Br2的氧化性大于I2。
(4)装置F的作用是除去污染性的物质(Cl2、Br2等),已知 Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,且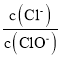 值与温度高低有关.若烧杯中装有500mL 0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。
值与温度高低有关.若烧杯中装有500mL 0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。