题目内容
8.下列说法正确的是( )| A. | IA族元素的金属性比IIA族元素的金属性强 | |
| B. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| C. | 第三周期元素的离子半径从左到右逐渐减小 | |
| D. | VIA族元素的氢化物中,稳定性最好的其沸点也最高 |
分析 A.同周期,从左向右金属性减弱;
B.同周期非金属元素最高价氧化物对应的水化物的酸性从左到右依次增加;
C.第三周期元素的阴离子,具有相同电子层结构,原子序数大的离子半径小;
D.非金属性越强,气态氢化物越稳定,分子间含有氢键的沸点较高.
解答 解:A.由元素周期律可知,同周期的IA族元素的金属性比IIA族的元素金属性强,故A错误;
B.同周期非金属元素最高价氧化物对应的水化物的酸性从左到右依次增加,不是最高价氧化物的水化物的酸性没有规律,故B错误;
C.第三周期元素的阴离子,具有相同电子层结构,则第三周期元素的阴离子半径从左到右逐渐减小,故C错误;
D.VIA族元素中O的非金属性最强,氢化物中稳定性最好的是H2O,H2O分子间含有氢键,沸点最高,故D正确;
故选D.
点评 本题考查同主族、同周期元素性质及元素化合物性质,为高频考点,把握同主族、同周期的位置关系及非金属性比较为解答的关键,选项D为易错点,注意特例应用,题目难度不大.

练习册系列答案
相关题目
18.元素周期表中某ⅠA族元素原子序数为x,则同一周期的ⅢA族元素原子序数不可能为( )
| A. | x+25 | B. | x+2 | C. | x+12 | D. | x+26 |
19.下列离子方程式正确的是( )
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
16.下列关于有机化合物的叙述正确的是( )
| A. | 有机物CH2=CHCH(CH3)CH2CH3和氢气加成后的产物的一氯取代物有3种 | |
| B. | 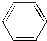 表示苯的分子结构,其中含有碳碳双键,因此苯的性质跟乙烯相同 表示苯的分子结构,其中含有碳碳双键,因此苯的性质跟乙烯相同 | |
| C. | 乙烯使溴水褪色和苯与溴水混合振荡后水层变为无色原理相同 | |
| D. | CH2Cl2是纯净物,说明甲烷是正四面体形结构而不是平面正方形结构 |
3.某溶液中含有NH4+、SO32-、SiO32-、Br -CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤溶液中共发生了2个氧化还原反应.
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤溶液中共发生了2个氧化还原反应.
| A. | ①②③④ | B. | ①②③④⑤ | C. | ①③④⑤ | D. | ②④⑤ |
20.A(g)+3B(g)?2C(g)△H=Q(Q<O)达到平衡,改变下列条件.正反应速率始终增大,直达到新平衡的是( )
| A. | 升温 | B. | c(A)增大 | C. | C(C)降低 | D. | C(A)降低 |
17.下列关于σ键和π键的理解正确的是( )
| A. | 气体单质中一定存在σ键,可能存在π键 | |
| B. | σ键可以绕键轴旋转,π键一定不能绕键轴旋转 | |
| C. | π键比σ键的电子云重叠程度大 | |
| D. | CH2=CHCl中C-Cl键采用的成键轨道是sp2-s |
18.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 验证NaCl溶液中混有盐酸 | 取少量溶液,滴加无色酚酞溶液 |
| B | 比较Fe、Cu、Ag的金属活动性 | 铁丝浸入CuSO4溶液,铜丝浸入AgNO3溶液 |
| C | 除去铁制品上的铁锈 | 将铁制品长时间浸泡在足量的稀硫酸中 |
| D | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
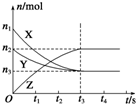 某温度时,在定容(V L)容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据上述图象可进行如下计算:
某温度时,在定容(V L)容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据上述图象可进行如下计算: