题目内容
2.设NA为阿伏加德罗常数的值.下列说法中,不正确的是:( )| A. | 常温下,4g CH4含有NA个C-H共价键 | |
| B. | 1 mol Fe与过量的稀硝酸反应过程中转移的电子数为2NA | |
| C. | 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
分析 A、质量换算物质的量结合甲烷分子结构计算碳氢键;
B、足量稀硝酸与铁反应生成三价铁;
C、NO2和N2O4的最简式相同;
D、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA.
解答 解:A、4g CH4物质的量为0.25mol,分子中含C-H共价键4×0.25×nA=nA个,故A正确;
B、稀硝酸过量,生成硝酸铁,转移电子应该是3 nA个电子,故B错误;
C、NO2和N2O4的最简式相同,92 g的NO2和N2O4混合气体含有的原子数$\frac{92g}{46g/mol}×3$=6NA;故C正确;
D、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA,故D正确;
故选B.
点评 本题考查了阿伏伽德罗常数的应用,主要考查了质量换算物质的量计算微粒数,氧化还原反应的产物分析,盐类水解的应用气体摩尔体积的条件应用,题目难度中等.

练习册系列答案
相关题目
6.下列表示对应化学反应的离子方程式正确的是( )
| A. | 漂白粉露置在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 向滴有酚酞的硅酸钠溶液中边加边振荡地滴加盐酸至红色变浅并接近消失:2H++SiO32-═H2SiO3(胶体) | |
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3═FeO42-+3Cl-+H2O+4H+ |
10.经测定某溶液中只含K+、CH3COO-、H+、OH-四种离子,下列说法错误的是( )
| A. | 若溶液呈中性,则c(K+)=c(CH3COO-) | |
| B. | 若溶液呈碱性,则c(K+)>c(CH3COO-) | |
| C. | 若溶液呈酸性,则c(H+)>c(CH3COO-)>c(K+) | |
| D. | 溶液呈电中性,则c(H+)+c(K+)=c(CH3COO-)+c(OH-) |
17.下列分子中的α键是由两个原子的p轨道以“头碰头”方式重叠构建而成的是( )
| A. | CCl4 | B. | Cl2 | C. | H2 | D. | HF |
7.下列说法正确的是( )
| A. | pH=3的盐酸和pH=5的硫酸等体积混合,pH=4 | |
| B. | 室温下,pH=9的碱性溶液中,可能存在CH3COOH分子 | |
| C. | 中性溶液中必然有c(H+)=c(OH-)=1×10-7 mol/L | |
| D. | 在0.1 mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
14.在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)?2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
| A. | A、B、C的分子数之比为1:3:2 | |
| B. | A、B、C的浓度相等 | |
| C. | 单位时间生成 nmol A,同时生成 3nmol B | |
| D. | 生成C的速率与C分解的速率相等 |
11.下列化学用语正确的是( )
| A. | CH4分子的结构式: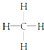 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | F-结构示意图: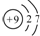 | D. | 氮分子的电子式: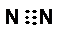 |
12.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和石油的分馏均属化学变化 | |
| B. | 蛋白质和蔗糖都属于高分子化合物,一定条件下都能水解 | |
| C. | 乙烯水化成乙醇,原子利用率为百分之百,符合绿色化学原理 | |
| D. | 淀粉与纤维素互为同分异构体 |

 ;写出E与G反应生成H的结构简式是
;写出E与G反应生成H的结构简式是 .
.