题目内容
6.下列表示对应化学反应的离子方程式正确的是( )| A. | 漂白粉露置在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 向滴有酚酞的硅酸钠溶液中边加边振荡地滴加盐酸至红色变浅并接近消失:2H++SiO32-═H2SiO3(胶体) | |
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3═FeO42-+3Cl-+H2O+4H+ |
分析 A.漂白粉的主要成分为次氯酸钙,次氯酸钙与二氧化碳反应生成碳酸钙沉淀;
B.硅酸钠为强碱弱酸盐,其溶液呈碱性,硅酸钠和稀盐酸反应生成难溶性硅酸和氯化钠,氯化钠为强碱强酸盐,其溶液呈中性;
C.氯气具有强氧化性,亚硫酸根离子被氧化成硫酸根离子;
D.强碱性溶液中,反应产物中不会存在氢氧根离子.
解答 解:A.Ca(ClO)2是漂白粉中有效成分,漂白粉置于空气中生成次氯酸和碳酸钙沉淀,正确的离子方程式为:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO,故A错误;
B.硅酸钠为强碱弱酸盐,其溶液呈碱性,硅酸钠和稀盐酸反应生成难溶性硅酸和氯化钠,氯化钠为强碱强酸盐,其溶液呈中性,离子方程式为2H++SiO32-═H2SiO3(胶体),故B正确;
C.氯气具有强氧化性,能够将S2O32-氧化成SO42-,正确的离子方程式应为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故C错误;
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4,反应的离子方程式为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,故D错误;
故选B.
点评 本题考查离子方程式的书写,题目难度中等,注意掌握离子方程式的书写原则,明确弱电解质、难溶物质、气体、氧化物等在离子方程式中写成化学式.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
16.下列有关纤维素的叙述正确的是( )
| A. | 纤维素在稀硫酸、加热的条件下水解 | |
| B. | 棉制品吸湿性好和分子中具有-OH有关 | |
| C. | 纤维指的就是纤维素 | |
| D. | 纤维素因分子结构中含-OH,可和浓HNO3发生硝化反应 |
17.下列关于化学反应速率及化学反应限度的说法正确的是( )
| A. | 当一个化学反应达到一定反应限度时,该反应就停止了 | |
| B. | 化学反应速率为“0.8mol•L-1•s-1”表示的意思是:时间为1s时,某物质的浓度为0.8mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的限度 | |
| D. | 对于不同的化学反应而言,化学反应速率大的不一定反应就快 |
1.如图为某原电池的示意图,则下列有关说法中正确的是( )


| A. | 锌片是正极 | |
| B. | 铜片上发生的反应为 Cu-2e-═Cu2+ | |
| C. | 电子由铜片通过导线流向锌片 | |
| D. | 该装置能够将化学能转化为电能 |
11.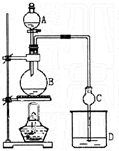 某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:
A中放醋酸,B中将过量的乙醇与少量浓硫酸混合,D中放有饱和碳酸钠溶液.经分液漏斗边滴加醋酸、边加热.
请回答:
(1)反应中加入的乙醇是过量的,其目的是增加一种反应物,有利于酯化反应正向进行;
(2)该反应中,若用CH3CH218OH与乙酸发生反应,则反应的化学方程式为CH3COOH+CH3CH218OH CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.
(3)球形干燥管C的作用是冷凝、防倒吸.
若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层,上层为无色油状液体,下层溶液颜色由红色变为无色(或变浅).
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)C,
目的是除水,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷B.碱石灰C.无水硫酸钠D.生石灰.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)反应中加入的乙醇是过量的,其目的是增加一种反应物,有利于酯化反应正向进行;
(2)该反应中,若用CH3CH218OH与乙酸发生反应,则反应的化学方程式为CH3COOH+CH3CH218OH
 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.(3)球形干燥管C的作用是冷凝、防倒吸.
若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层,上层为无色油状液体,下层溶液颜色由红色变为无色(或变浅).
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)C,
目的是除水,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷B.碱石灰C.无水硫酸钠D.生石灰.
5.下列物质分类错误的是( )
| A. | 同系物:CH2O2、C2H4O2、C3H6O2 | B. | 化合物:五水硫酸铜、烧碱、冰醋酸 | ||
| C. | 电解质:Al2O3、NaOH、CaCO3 | D. | 同素异形体:金刚石、石墨、足球烯 |
2.设NA为阿伏加德罗常数的值.下列说法中,不正确的是:( )
| A. | 常温下,4g CH4含有NA个C-H共价键 | |
| B. | 1 mol Fe与过量的稀硝酸反应过程中转移的电子数为2NA | |
| C. | 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |




 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.