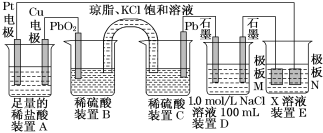
题目内容
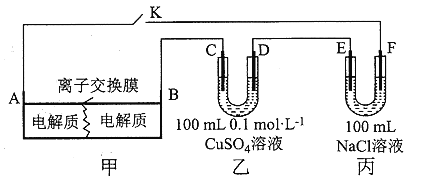
【题目】如图装置甲是某可充电电池的示意图,该电池放电的化学方程式为![]() ,图中的离子交换膜只允许
,图中的离子交换膜只允许![]() 通过,C、D、F均为石墨电极,E为铜电极。工作一段时间后,断开K,此时C、D两电极产生的气体体积相同,E电极质量减少
通过,C、D、F均为石墨电极,E为铜电极。工作一段时间后,断开K,此时C、D两电极产生的气体体积相同,E电极质量减少![]() 。
。
(1)装置甲的A电极为电池的_______极,电解质中的![]() 从离子交换膜的_________
从离子交换膜的_________![]() 填“左侧”或“右侧”,下同
填“左侧”或“右侧”,下同![]() 向离子交换膜的_________迁移;B电极的电极反应式为_______。
向离子交换膜的_________迁移;B电极的电极反应式为_______。
(2)装置乙D电极析出的气体是___________,体积为___________![]() 标准状况
标准状况![]() 。
。
(3)若将装置丙中的NaCl溶液换成![]() 和
和![]() 的混合溶液。从反应初始至反应结束,丙装置溶液中金属阳离子物质的量浓度与转移电子的物质的量的变化关系如图所示。
的混合溶液。从反应初始至反应结束,丙装置溶液中金属阳离子物质的量浓度与转移电子的物质的量的变化关系如图所示。
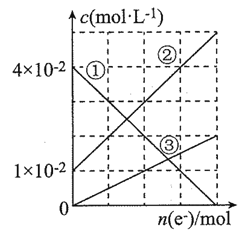
①图中②表示的是__________![]() 填金属离子符号
填金属离子符号![]() 的变化曲线。
的变化曲线。
②反应结束后,若用![]() 溶液沉淀丙装置溶液中的金属阳离子
溶液沉淀丙装置溶液中的金属阳离子![]() 设溶液体积为
设溶液体积为![]() ,则至少需要
,则至少需要![]() 溶液________mL。
溶液________mL。
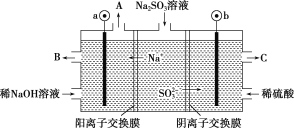
(4)该小组运用工业上离子交换膜法制烧碱的原理,用如图所示装置电解![]() 溶液。
溶液。
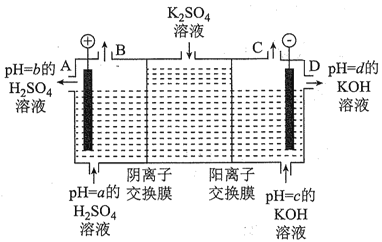
①该电解槽的阳极反应式为_____________,通过阴离子交换膜的离子数_______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 通过阳离子交换膜的离子数。
通过阳离子交换膜的离子数。
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为_________。
③电解一段时间后,B口与C口产生气体的质量比为__________________。
【答案】负 左侧 右侧 ![]()
![]() 或氢气
或氢气![]() 224
224 ![]()
![]()
![]()
![]()
![]()
![]()
【解析】
(1)丙为电解池,E为铜电极,E电极质量减少,根据电解原理,E为阳极,F为阴极,A为负极,B为正极;然后根据电解原理,据此分析;
(2)装置乙为电解池,C和D惰性材料作电极,根据电解原理进行分析;
(3)电解前阳离子是Fe3+、Fe2+、H+,电解过程中阳离子增加Cu2+,根据阳离子放电顺序Fe3+>Cu2+>H+>Fe2+,Fe3+最先放电,电极反应式为Fe3++e-=Fe2+,Fe3+减少的物质的量与Fe2+增加的物质的量相等,据此分析;
(4)左端电极反应式为2H2O-4e-=O2↑+4H+,右端电极反应式为2H2O+2e-=H2↑+2OH-,据此分析;
(1)根据E的材料为铜,且工作一段时间,铜的质量减少,E为阳极,B为正极,A为负极;原电池内部阳离子移向正极,即从左侧移向右侧;根据给定的原电池的总反应,结合B极为正极可知B极的电极反应式为![]() ,
,
答案为:负;左侧;右侧;![]() ;
;
(2)根据上述分析可知D极为阴极,所以产生的气体为氢气;E电极质量减少![]() ,所以转移的电子的物质的量为
,所以转移的电子的物质的量为![]() ,D电极反应分为两个阶段,第一阶段是铜离子得电子产生铜单质,第二阶段是氢离子得到电子产生氢气,因此根据串联电路中电子转移量相等可得氢气的物质的量为
,D电极反应分为两个阶段,第一阶段是铜离子得电子产生铜单质,第二阶段是氢离子得到电子产生氢气,因此根据串联电路中电子转移量相等可得氢气的物质的量为![]() ,其在标准状况下的体积为
,其在标准状况下的体积为![]() ,
,
答案为:![]() 或氢气
或氢气![]() ;224;
;224;
(3)①若将装置丙中的NaCl溶液改换成![]() 和
和![]() 的混合溶液,阳离子放电顺序为
的混合溶液,阳离子放电顺序为![]() ,最先放电的是
,最先放电的是![]() ,电极方程式为
,电极方程式为![]() ,
,![]() 减小的物质的量与
减小的物质的量与![]() 增加的物质的量相等,则
增加的物质的量相等,则![]() 表示的是
表示的是![]() 的变化曲线,
的变化曲线,![]() 表示的是
表示的是![]() 的变化曲线,
的变化曲线,![]() 表示的是
表示的是![]() 的变化曲线,
的变化曲线,
答案为:![]() ;
;
②电解结束后,加入NaOH溶液时,溶液中![]() 和
和![]() 与NaOH发生反应,由图可知共消耗NaOH的物质的量为
与NaOH发生反应,由图可知共消耗NaOH的物质的量为![]() ,则至少需要
,则至少需要![]() 溶液的体积为
溶液的体积为![]() ;
;
答案为:28;
(4)①根据装置图可知左边为阳极区,应为水电离产生的氢氧根失去电子,的电极反应式为![]() ;通过阴离子交换膜的离子为SO42-,通过阳离子交换膜的阳离子为K+,根据硫酸根和钾离子所带电荷数可知,阳离子数目多与阴离子数目,
;通过阴离子交换膜的离子为SO42-,通过阳离子交换膜的阳离子为K+,根据硫酸根和钾离子所带电荷数可知,阳离子数目多与阴离子数目,
答案为:![]() ;
;![]() ;
;
②根据装置图分析可知![]() 硫酸转化为
硫酸转化为![]() 的硫酸时,硫酸浓度增大,pH减小;
的硫酸时,硫酸浓度增大,pH减小;![]() 的氢氧化钾转化为
的氢氧化钾转化为![]() 的氢氧化钾时,氢氧化钾浓度增大,pH增大,因此pH大小关系为
的氢氧化钾时,氢氧化钾浓度增大,pH增大,因此pH大小关系为![]() ,
,
答案为:![]() ;
;
③根据装置图分析可知该装置电解的本质是电解水,B口产生氧气,C口产生氢气,根据得失电子守恒可知氧气和氢气的质量比为![]() ,
,
答案为:![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4=K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是__________________。
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
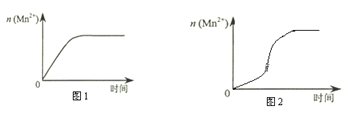
该小组同学提出的假设是___________________________________________________。
(3)测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。
Ⅰ、滴定终点的现象是_________________________________。
Ⅱ、下列操作会导致测定结果偏低的是______。
A.锥形瓶用待测草酸溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
Ⅲ、计算:血液中含钙离子的浓度为______mol/L。