题目内容
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种比氯气更好的净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下,回答下列问题: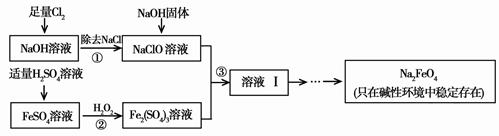
(1)氯气作净水消毒剂是因为它溶于水生成了________,它有强的氧化性,能杀菌消毒。
(2)步骤②反应的离子方程式是 。
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为 。
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线II比曲线I对应的污水pH________(填“高”或“低”)。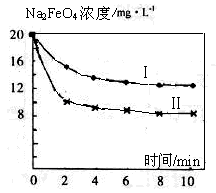
(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_____倍
(1)次氯酸或HClO (2)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
(3)2Fe3+ + 3ClO- + 10OH- = 2FeO42- + 3Cl- + 5H2O (4)低 (5)0.64。
解析试题分析:(1)氯气在水中发生反应:Cl2+H2O="HCl+HClO." HclO有强的氧化性,能对水杀菌、消毒。(2)H2O2有强的氧化性,在酸性条件下把Fe2+氧化成Fe3+,它本身被还原为H2O。步骤②反应的离子方程式是2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O。(3)ClO-能在碱性条件下把Fe3+氧化成FeO42-,它本身被还为Cl-。步骤③中反应的离子方程式为2Fe3+ + 3ClO- + 10OH- = 2FeO42- + 3Cl- + 5H2O 。(4)FeO42-在酸性条件下氧化能力比碱性条件下强,浓度变化大。所以曲线II比曲线I对应的污水pH小,即酸性强。(5)Na2FeO4的消毒效率是:3NA÷166;氯气的消毒效率是:2NA÷71.所以Na2FeO4的消毒效率与氯气消毒效率之比为:(3NA÷166):(2NA÷71)=0.64..
考点:考查净水消毒剂高铁酸钠(Na2FeO4)的制法、消毒效率及相应的化学反应原理。

 教学练新同步练习系列答案
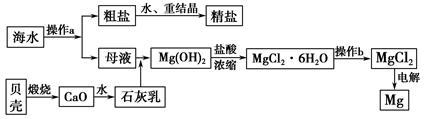
教学练新同步练习系列答案工业利用精炼镁渣(含有MgO、KCl、MgCl2、BaCl2、CaCl2、FeCl3等杂质)回收MgCl2的工业流程如下:
已知:25℃时有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | BaCO3 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 5.1×10-9 | 5.61×10-12 | 2.64×10-38 |
回答下列问题:
(1)写出溶解时的离子方程式
(2)溶解时温度不能太高,也不宜太低,要求控制在35℃左右,其理由是
(3)操作I包含多个操作,分别为 过滤,洗涤,烘干。烘干时需要减压烘干,原因是 。
(4)为减少Na2CO3的用量和提高产品质量,在中和工序(中和后溶液接近中性)结束前要检验溶液中是否存在 离子,选择检验该离子的原因是 。
(5)母液的主要成分 。
某地农田土壤胶体的胶粒带负电荷,若在该农田里施用含氮量相等的下列化肥,有效成分利用率最差的是 ( )。
| A.(NH4)2SO4 | B.NH4HCO3 |
| C.NH4NO3 | D.NH4Cl |
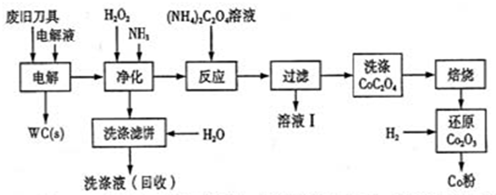


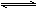 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
