题目内容
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: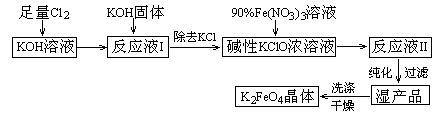
已知:① 2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4可作为新型多功能水处理剂的原因 ;
(4)与MnO2 -Zn电池类似,K2FeO4 -Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
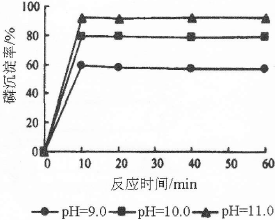
(5)在“反应液I ”中加KOH固体的目的是① ,② ;
(6)从“反应液II ”中分离出K2FeO4后,副产品是 (写化学式)。
(1)温度较低(1分)
(2)2NaCl + 2H2O  2NaOH + H2↑ + Cl2↑(2分)
2NaOH + H2↑ + Cl2↑(2分)
(3)+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;(1分)还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉。(1分)
(4)FeO42-+3e-+4H2O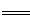 Fe(OH)3+5OH-;(2分)
Fe(OH)3+5OH-;(2分)
2FeO42-+8H2O+3Zn 2Fe(OH)3+ 3Zn(OH)3+4OH-(2分)
2Fe(OH)3+ 3Zn(OH)3+4OH-(2分)
(5)与“反应液I”中过量的Cl2继续反应,生成更多的KClO;为下一步反应提供反应物(各2分)
(6)KNO3 KCl(2分)
解析试题分析:(1)由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,由信息②可知温度较高KOH与Cl2反应生成的是KClO3.由信息①可知,在低温下KOH与Cl2反应生成的是KClO.故选择低温较低,故答案为:温度较低;
(2)工业是利用电解饱和食盐水制取氯气.反应方程式为:2NaCl+2H2O  2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(3)K2FeO4中铁元素化合价为+6价,价态高,易得电子,表现强氧化性,+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并使泥沙聚沉;
(4)原电池的负极发生氧化反应,正极电极反应式为:①FeO42-+3eˉ+4H2O Fe(OH)3+5OH-;负极电极反应为:②Zn-2e-+2OH-
Fe(OH)3+5OH-;负极电极反应为:②Zn-2e-+2OH- Zn(OH)2;依据电极反应的电子守恒,①×2+②×3合并得到电池反应为:3Zn+2FeO42-+8H2O
Zn(OH)2;依据电极反应的电子守恒,①×2+②×3合并得到电池反应为:3Zn+2FeO42-+8H2O 3Zn(OH)2+2Fe(OH)3+4OH-,
3Zn(OH)2+2Fe(OH)3+4OH-,
(5)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应,生成更多的KClO.为下一步反应提供反应物;
(6)由工艺流程及③可知,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl.
考点:考查对工艺流程的理解。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下: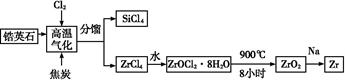
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO): ;
(2)写出ZrOCl2·8H2O在900 ℃生成ZrO2的反应方程式 ;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 (单选)。
| A.二氧化锆纳米陶瓷是新型无机非金属材料 |
| B.1纳米=10-10米 |
| C.锆合金的硬度比纯锆要高 |
| D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起 |
某复合材料是以人工碳纤维为增强体、金属钛为基体复合而成的。估计这种材料具有的性质或用途是( )。
①耐高温;②不耐热;③导电、导热;④不导电、不导热;⑤可用于飞机机翼;⑥可用于导弹的壳体
| A.①③⑤⑥ | B.②③⑤⑥ |
| C.②③④ | D.③④⑤ |
下列关于工业生产说法错误的是( )
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通入氨气,后通入二氧化碳 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |