题目内容
工业利用精炼镁渣(含有MgO、KCl、MgCl2、BaCl2、CaCl2、FeCl3等杂质)回收MgCl2的工业流程如下:
已知:25℃时有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | BaCO3 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 5.1×10-9 | 5.61×10-12 | 2.64×10-38 |
回答下列问题:
(1)写出溶解时的离子方程式
(2)溶解时温度不能太高,也不宜太低,要求控制在35℃左右,其理由是
(3)操作I包含多个操作,分别为 过滤,洗涤,烘干。烘干时需要减压烘干,原因是 。
(4)为减少Na2CO3的用量和提高产品质量,在中和工序(中和后溶液接近中性)结束前要检验溶液中是否存在 离子,选择检验该离子的原因是 。
(5)母液的主要成分 。
(16分)
(1)MgO+2H+=H2O+Mg2+(2分)
(2)溶解时温度太低,反应速率过慢,温度太高, HCl会挥发(3分)
(3)蒸发浓缩,冷却结晶(2分);降低烘干时的温度,防止MgCl2·6H2O分解(3分)
(4) Ba2+(2分);BaCO3溶解度仅小于MgCO3的溶解度,而大于其他物质的溶解度,当Ba2+除尽时,其它杂质已经除尽(2分)
(5)KCl 、NaCl和MgCl2(2分)
解析试题分析:(1)根据镁渣组成及各成分的溶解性可知,加入盐酸的目的是溶解MgO,氧化镁是碱性氧化物,与过量盐酸反应生成氯化镁和水,即MgO+2H+=H2O+Mg2+;(2)溶解温度过低,反应速率太小,温度过高,过量的盐酸易挥发,促进铁离子、镁离子的水解,导致目标产物的生产效率过低;(3)操作I是将过滤所得溶液变为氯化镁的结晶水合物,根据混合物分离提纯方法可知,该操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;烘干时温度过高,六水合氯化镁能失去结晶水,因此应降低烘干的温度,防止结晶水化合物分解,所以采取减压烘干;(4)读表中各物质的溶度积可知,溶度积:MgCO3>BaCO3>CaCO3>Mg(OH)2>Fe(OH)3,根据沉淀转化的原理可知,MgCO3(s)+Ba2+ BaCO3(s)+Mg2+,BaCO3(s)+Ca2+
BaCO3(s)+Mg2+,BaCO3(s)+Ca2+ BaCO3(s)+Ba2+,由于目标产物中含有镁离子,因此不能开始沉淀镁离子,只能完全沉淀钙离子、铁离子、钡离子,因为BaCO3溶解度仅小于MgCO3的溶解度,而大于其他物质的溶解度,当Ba2+除尽时,其它杂质已经除尽,因此中和结束前应检验溶液中是否存在Ba2+;(5)过饱和溶液结晶析出之后,母液扔是氯化镁的饱和溶液,此外还有原料中或除杂过程中没有分离的易溶物(如KCl、NaCl),因此母液的主要成分是MgCl2、KCl、NaCl。
BaCO3(s)+Ba2+,由于目标产物中含有镁离子,因此不能开始沉淀镁离子,只能完全沉淀钙离子、铁离子、钡离子,因为BaCO3溶解度仅小于MgCO3的溶解度,而大于其他物质的溶解度,当Ba2+除尽时,其它杂质已经除尽,因此中和结束前应检验溶液中是否存在Ba2+;(5)过饱和溶液结晶析出之后,母液扔是氯化镁的饱和溶液,此外还有原料中或除杂过程中没有分离的易溶物(如KCl、NaCl),因此母液的主要成分是MgCl2、KCl、NaCl。
考点:考查物质制备化学工艺流程,涉及关键步骤的离子方程式及控制温度的原因、混合物分离提纯的方法、解释减压烘干目标产物的原因、利用溶度积及沉淀转化规律解释原因、母液的主要成分的推断等。

某复合材料是以人工碳纤维为增强体、金属钛为基体复合而成的。估计这种材料具有的性质或用途是( )。
①耐高温;②不耐热;③导电、导热;④不导电、不导热;⑤可用于飞机机翼;⑥可用于导弹的壳体
| A.①③⑤⑥ | B.②③⑤⑥ |
| C.②③④ | D.③④⑤ |
下列关于工业生产说法错误的是( )
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通入氨气,后通入二氧化碳 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |
高效肥料一般是指含营养成分在30%以上的化肥。下列不属于高效肥料的是( )。
| A.尿素 | B.硝酸铵 | C.液氨 | D.氯化铵 |
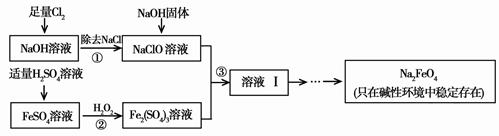
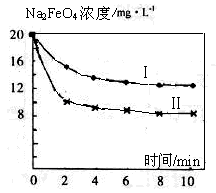

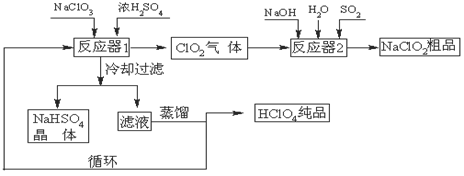

 LiF↓,该反应的平衡常数表达式为K= 。
LiF↓,该反应的平衡常数表达式为K= 。
 Al(OH)3+3H+的平衡常数为 (保留两位有效数字);
Al(OH)3+3H+的平衡常数为 (保留两位有效数字);