题目内容
下列化学过程及其表述正确的是( )
| A、向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH═BaSO4↓+H2O |
| B、由水电离的c(H+)为10-3mol?L-1的溶液中,Na+、NO3-、SO32-、Cl-一定能大量共存 |
| C、向含有1mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol |
| D、可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以汪明H2O2具有还原性2MnO4+6H++5H2O2═2Mn2++5O2↑+8H2O |
考点:离子方程式的书写,离子共存问题
专题:离子反应专题
分析:A.该离子方程式中,钡离子与氢氧根离子不满足氢氧化钡的化学式组成;
B.由水电离的c(H+)为10-3mol?L-1的溶液可能为酸性或者碱性溶液,亚硫酸根离子能够与氢离子反应;
C.1mol KAl(SO4)2含有1molAl3+,2molSO42-,开始发生反应SO42-+Ba2+=BaSO4↓,Al3++3OH-=A1(OH)3↓,Al3+完全沉淀,再继续滴加Ba(OH)2溶液,发生反应A1(OH)3+OH-=A1O2-+2H2O,SO42-+Ba2+=BaSO4↓,判断Al3+完全沉淀后再滴加Ba(OH)2溶液沉淀的质量变化,确定沉淀质量最大时硫酸铝钾与氢氧化钡物质的量之比为1:2;
D.酸性高锰酸钾溶液具有强氧化性,能够氧化氯离子,无法证明双氧水具有还原性,应该用稀硫酸酸化.
B.由水电离的c(H+)为10-3mol?L-1的溶液可能为酸性或者碱性溶液,亚硫酸根离子能够与氢离子反应;
C.1mol KAl(SO4)2含有1molAl3+,2molSO42-,开始发生反应SO42-+Ba2+=BaSO4↓,Al3++3OH-=A1(OH)3↓,Al3+完全沉淀,再继续滴加Ba(OH)2溶液,发生反应A1(OH)3+OH-=A1O2-+2H2O,SO42-+Ba2+=BaSO4↓,判断Al3+完全沉淀后再滴加Ba(OH)2溶液沉淀的质量变化,确定沉淀质量最大时硫酸铝钾与氢氧化钡物质的量之比为1:2;
D.酸性高锰酸钾溶液具有强氧化性,能够氧化氯离子,无法证明双氧水具有还原性,应该用稀硫酸酸化.
解答:
解:A.向NaHSO4溶液中滴入Ba(OH)2溶液至中性,硫酸氢钠与氢氧化钡的物质的量之比为2:1,正确的离子方程式为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故A错误;
B.由水电离的c(H+)为10-3mol?L-1的溶液中可能存在大量氢离子或者氢氧根离子,SO32-能够与氢离子发生反应,在溶液中不能大量共存,故B错误;
C.明矾的物质的量为1 mol,则当滴加的Ba(OH)2的物质的量分别在0~1.5 mol和1.5 mol~2.0 mol时,所发生的反应的化学方程式分别为:2KAl(SO4)2+3Ba(OH)2═K2SO4+3BaSO4↓+2Al(OH)3↓①,K2SO4+2Al(OH)3+Ba(OH)2═2KAlO2+BaSO4↓+4H2O②;由方程式①知,当加入了1.5 mol Ba(OH)2时,生成沉淀的物质的量为1.5 mol+1 mol=2.5 mol,质量为1.5 mol×233 g/mol+1 mol×78 g/mol=427.5 g;由方程式②知,当继续滴加0.5 mol Ba(OH)2时,沉淀的物质的量将减少0.5 mol×2=1 mol,沉淀的质量却增加0.5 mol×233 g/mol-78 g=38.5 g,所以把SO42-沉淀完全时,生成沉淀的质量最大,需要加入氢氧化钡2mol,故C正确;
D.由于酸性高锰酸钾溶液能够氧化氯化氢电离的氯离子,导致酸性高锰酸钾溶液褪色,干扰了双氧水的检验,所以不能使用盐酸酸化,可以使用稀硫酸,故D错误;
故选C.
B.由水电离的c(H+)为10-3mol?L-1的溶液中可能存在大量氢离子或者氢氧根离子,SO32-能够与氢离子发生反应,在溶液中不能大量共存,故B错误;
C.明矾的物质的量为1 mol,则当滴加的Ba(OH)2的物质的量分别在0~1.5 mol和1.5 mol~2.0 mol时,所发生的反应的化学方程式分别为:2KAl(SO4)2+3Ba(OH)2═K2SO4+3BaSO4↓+2Al(OH)3↓①,K2SO4+2Al(OH)3+Ba(OH)2═2KAlO2+BaSO4↓+4H2O②;由方程式①知,当加入了1.5 mol Ba(OH)2时,生成沉淀的物质的量为1.5 mol+1 mol=2.5 mol,质量为1.5 mol×233 g/mol+1 mol×78 g/mol=427.5 g;由方程式②知,当继续滴加0.5 mol Ba(OH)2时,沉淀的物质的量将减少0.5 mol×2=1 mol,沉淀的质量却增加0.5 mol×233 g/mol-78 g=38.5 g,所以把SO42-沉淀完全时,生成沉淀的质量最大,需要加入氢氧化钡2mol,故C正确;
D.由于酸性高锰酸钾溶液能够氧化氯化氢电离的氯离子,导致酸性高锰酸钾溶液褪色,干扰了双氧水的检验,所以不能使用盐酸酸化,可以使用稀硫酸,故D错误;
故选C.
点评:本题考查了离子方程式的酸性、离子方程的正误判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,选项C为易错点,注意合理分析生成沉淀质量最大时硫酸铝钾和氢氧化钡的物质的量关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图是某种微粒的结构示意图,x为( )


| A、8 | B、10 | C、11 | D、无法确定 |
“信息”、“材料”和“能源”被称为新科技革命的三大支柱.下列说法错误的是( )
| A、在即将到来的新能源时代,核能、太阳能、氢能将可能成为主要能源 |
| B、开发太阳能、氢能等新型能源有利于减少二氧化碳的排放量 |
| C、煤的气化技术是减少二氧化碳排放的重要措施 |
| D、煤的“气化”和“液化”技术可提高煤的综合利用效率 |
下列叙述正确的是( )
| A、常温常压下,4.6g NO2气体约含有1.81×1023个原子 |
| B、在标准状况下,80g SO3所占的体积约为22.4L |
| C、常温下,0.1mol?L-1醋酸溶液的pH约为1 |
| D、标准状况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA |
下列对有机物结构或性质的描述中错误的是( )
| A、一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| B、乙烷和丙烯的物质的量共1mol,完成燃烧生成3mol H2O |
| C、用水可区分苯和溴苯 |
D、如图中有机物的一氯代物有4种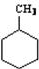 |
下列关于有机物的说法正确的是( )
| A、苯乙烯分子中所有原子可能在同一个平面上 |
| B、分子式为C7H8O且分子中有苯环有机物共有4种 |
| C、乙醇和甘油互为同系物 |
| D、除去乙醇中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液 |
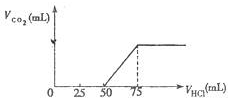 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A、产生的CO2体积(标准状况下)为0.056L |
| B、原NaOH溶液的物质的量浓度为0.5mol?L-1 |
| C、OA段所发生反应的离子方程式:H++OH-═H2O;CO32-+H+═HCO3- |
| D、NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 |
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法错误的是( )
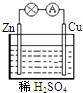

| A、溶液中H+向负极移动 |
| B、电子由Zn经外电路流向Cu |
| C、Zn电极反应:Zn-2e-=Zn2+ |
| D、Cu是正极 |