题目内容
【题目】钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如下(已知:TiO2+易水解,只能存在于强酸性溶液中):
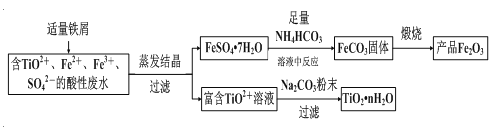
(1)富含TiO2+溶液中加入Na2CO3粉末能得到固体TiO2nH2O,其原理是______________。
(2)制取FeCO3发生的化学方程式为______________________;反应温度一般需控制在35℃以下,其目的是______________。
(3)已知Ksp[Fe(OH)2]=8×10-16。制取FeCO3时,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6mol·L-1。试判断所得的FeCO3中______(填“有”或“没有”)Fe(OH)2;煅烧中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是_________。
(4)为了控制NH4HCO3用量需要测定固体中FeSO47H2O的含量。称1g固体样品,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol·L-1KMnO4标准溶液滴定到溶液刚好变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
MnO4-(紫红)+5Fe2++8H+=Mn2+(粉红)+5Fe3++4H2O
5Fe3+(黄)+2H3PO4=H3[Fe(PO4)2](无色)+3H+
①H3PO4的作用____________。②样品中FeSO47H2O的含量为___________%。
【答案】因为发生水解反应:TiO2++(n+1)H2O![]() TiO2nH2O+2H+,加入Na2CO3后,CO32-与H+反应,c(H+)减小,水解平衡正反应方向移动 FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑ 防止NH4HCO3分解或减小Fe2+水解 没有 向反应容器中补充适量空气(氧气) 消除Fe3+的颜色干扰 2.78V
TiO2nH2O+2H+,加入Na2CO3后,CO32-与H+反应,c(H+)减小,水解平衡正反应方向移动 FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑ 防止NH4HCO3分解或减小Fe2+水解 没有 向反应容器中补充适量空气(氧气) 消除Fe3+的颜色干扰 2.78V
【解析】
钛矿工业中的酸性废水富含Ti、Fe等元素,含有TiO2+、Fe2+、Fe3+等离子,加入铁粉还原铁离子得到亚铁离子,通过蒸发浓缩、冷却结晶过滤洗涤、干燥得到硫酸亚铁晶体,配制成溶液调节溶液pH5~5.8范围内,加入足量碳酸氢铵,过滤得到碳酸亚铁沉淀,在坩埚中灼烧得到氧化铁,过滤后得到富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O![]() TiO2nH2O+2H+向生成TiO2nH2O的方向移动,可得到TiO2粗产品。
TiO2nH2O+2H+向生成TiO2nH2O的方向移动,可得到TiO2粗产品。
(1)富含TiO2+溶液中加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平TiO2++(n+1)H2O![]() TiO2nH2O+2H+向生成TiO2nH2O的方向移动;
TiO2nH2O+2H+向生成TiO2nH2O的方向移动;
(2)制取FeCO3中发生反应是硫酸亚铁和碳酸氢铵反应生成碳酸亚铁沉淀、硫酸铵、二氧化碳和水,反应温度一般需控制在35°C以下,是为了避免温度过高碳酸氢铵分解,减少亚铁离子的水解程度;
(3)根据溶液中c(Fe2+)·c(OH-)2与Ksp[Fe(OH)2]比较,可判断有无Fe(OH)2沉淀,保证二价铁被氧化为三价需要多通入空气或氧气;
(4)①根据反应方程式及高锰酸钾的物质的量计算出产品中FeSO4.7H2O的质量分数;
②根据题给信息判断。
(1)富含TiO2+溶液中加入Na2CO3粉末与溶液中的H+反应,降低了溶液中c(H+),使平TiO2++(n+1)H2O![]() TiO2nH2O+2H+,向生成TiO2nH2O的方向移动,可得到TiO2粗产品,故答案为:因为发生水解反应:TiO2++(n+1)H2O
TiO2nH2O+2H+,向生成TiO2nH2O的方向移动,可得到TiO2粗产品,故答案为:因为发生水解反应:TiO2++(n+1)H2O![]() TiO2nH2O+2H+,加入Na2CO3后,CO32-与H+反应,c(H+)减小,水解平衡正反应方向移动;
TiO2nH2O+2H+,加入Na2CO3后,CO32-与H+反应,c(H+)减小,水解平衡正反应方向移动;
(2)制取FeCO3中发生反应是硫酸亚铁和碳酸氢铵反应生成碳酸亚铁沉淀、硫酸铵、二氧化碳和水,反应的化学方程式为:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑反应温度一般需控制在35°C以下,是为了避免温度过高碳酸氢铵分解,减少亚铁离子的水解程度,故答案为:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑;避免温度过高碳酸氢铵分解,减少亚铁离子的水解程度;
(3)室温下测得溶液的pH为8.5,由题中数据可知,溶液中c(Fe2+)·c(OH-)2=1x10-6×(1×10-5.5)=10-17<Ksp[Fe(OH)2]=8x10-16,故无Fe(OH)2沉淀生成;煅烧中,为了得到较为纯净的Fe2O3,需要将亚铁完全氧化为三价铁,除了适当的温度外,还需要采取的措施是向反应容器中补充适量空气(氧气),故答案为:没有;向反应容器中补充适量空气(氧气);
(4)①铁离子颜色呈黄色,干扰终点判断,而5Fe3+(黄)+2H3PO4=H3[Fe(PO4)2](无色)+3H+,消除了铁离子干扰,故答案为:消除Fe3+的颜色干扰;
②待测液消耗的高锰酸钾的物质的量为:0.02mol/L×VmL×10-3L/mL=2V×10-5mol,根据反应:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,硫酸亚铁的物质的量为:2V×10-5mol×5=V×10-4mol,所以样品中含有的FeSO47H2O的质量为:278g/mol×V×10-4mol=2.78V×10-2g,FeSO47H2O的质量分数为:![]() =2.78V%;
=2.78V%;
故答案为:2.78V。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案