题目内容
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2.
8Cu+4FeO+2Fe2O3+16SO2.
(1)若CuFeS2中Fe的化合价为+2,反应中被还原的元素是__(填元素符号).
(2)用稀H2SO4浸泡上述反应制取铜后剩余的固体残渣,取少量所得溶液,检验溶液中存在Fe3+的方法是__(注明试剂、现象).
(3)上述冶炼过程产生大量SO2.下列处理方案中合理的是__(填代号)
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(4)验证黄铜矿冶炼铜的反应后气体中含有SO2的方法是__.
(5)实验室制备,收集干燥的SO2,所需仪器如下.
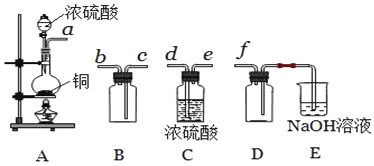
①其中装置A产生SO2,反应的化学方程式为__.
②请按气流方向连接各仪器接口,顺序为a→__→ → → f,装置E中NaOH溶液的作用是__.E中反应的离子方程式__.
【答案】 Cu、O 取少量溶液,滴加KSCN溶液,溶液变红 bc 将气体通入品红溶液中,如果品红溶液褪色,加热后又变红,则证明有SO2 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O d;e;c;b 吸收多余的SO2,防止污染空气 SO2+2OH-=SO32++H2O
CuSO4+SO2↑+2H2O d;e;c;b 吸收多余的SO2,防止污染空气 SO2+2OH-=SO32++H2O
【解析】(1)8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2中,Cu元素的化合价由+2价降低为0、O元素的化合价由0降低为-2价,化合价降低的元素被还原,故Cu、O被还原;故答案为:Cu、O;
8Cu+4FeO+2Fe2O3+16SO2中,Cu元素的化合价由+2价降低为0、O元素的化合价由0降低为-2价,化合价降低的元素被还原,故Cu、O被还原;故答案为:Cu、O;
(2)用稀H2SO4浸泡上述反应制取铜后剩余的固体残渣,取少量所得溶液,检验溶液中存在Fe3+的方法是取少量溶液,滴加KSCN溶液,溶液变红;故答案为:取少量溶液,滴加KSCN溶液,溶液变红;
(3)二氧化硫为环境污染物,不能高空排放,与浓硫酸不反应,可用于制备硫酸或亚硫酸盐,只有bc符合;故答案为:bc;
(4)验证黄铜矿冶炼铜的反应后气体中含有SO2的方法是将气体通入品红溶液中,如果品红溶液褪色,加热后又变红,则证明有SO2;故答案为:将气体通入品红溶液中,如果品红溶液褪色,加热后又变红,则证明有SO2;
(5)①装置A产生SO2,反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
②根据装置A为反应装置,C为干燥装置,B为收集装置,D为防止倒吸,E为尾气处理,则按气流方向连接各仪器接口,顺序为a→d→e→c→b→f;装置E中NaOH溶液的作用是吸收多余的SO2,防止污染空气,发生的离子方程式为:SO2+2OH-=SO32-+H2O;故答案为:d;e;c;b;吸收多余的SO2,防止污染空气;SO2+2OH-=SO32-+H2O。

 阅读快车系列答案
阅读快车系列答案