题目内容
下列各示意图与对应的表述正确的是:
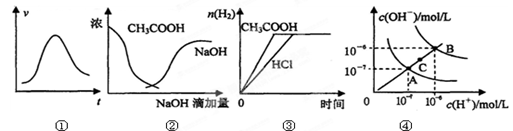

| A.图①表示一定条件下某化学反应的速率随时间变化的趋势图,该反应一定为放热反应 |
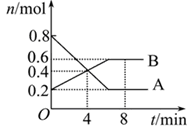
| B.图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液浓度的变化趋势图 |
| C.图③表示等体积、等物质的量浓度的盐酸和醋酸,分别加足量镁粉,产生H2的物质的量的变化 |
| D.图④为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
B
试题分析:A.随着反应的进行,速率逐渐增大,当反应进行到一定程度时速率达到最大值,后来反应速率又逐渐降低,改变速率的原因可能是温度对平衡的影响,也可能是降低物质的浓度或改变压强等。因此不能该反应为放热反应还是吸热反应。错误。B.醋酸是弱酸,在溶液中主要以电解质分子的形式存在。当把NaOH滴加后,发生反应:CH3COOH+OH-=CH3COO-+H2O,所以CH3COOH逐渐降低,当二者恰好反应时CH3COOH、OH-的浓度最小,后来碱过量,OH-的浓度逐渐增大。因此图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液浓度的变化趋势图。正确。C.由于盐酸是强酸,醋酸是弱酸,所以等体积等浓度的盐酸和醋酸中,二者的物质的量相同,c(H+)盐酸大,因此向其中加入足量的Mg时放出氢气的速率开始时盐酸快,随着反应的进行,c(H+)都降低,盐酸的降低的快,醋酸降低的慢,所以达到氢气最大量HCl快,但最终二者产生的氢气相同。错误。D.图④为水的电离平衡曲线图,由于水的离子积常数只与温度有关,所以若从A点到C点,可采用方法是升高温度。错误。

练习册系列答案
相关题目
 X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下: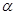 1
1
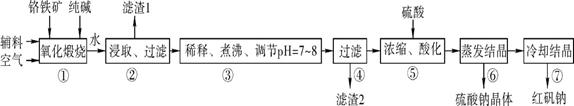
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2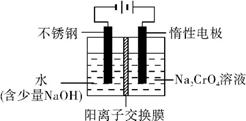
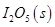 可用于检测CO,反应原理为:
可用于检测CO,反应原理为: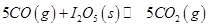
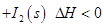 。向2L密闭容器中加入足量
。向2L密闭容器中加入足量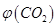 随时间的变化如下图所示。
随时间的变化如下图所示。
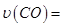 _____________。
_____________。 的体积分数
的体积分数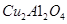 为催化剂,可以将
为催化剂,可以将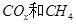 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。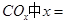 ______________。
______________。 ________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
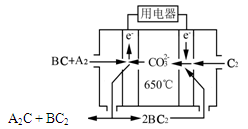
________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。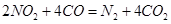 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。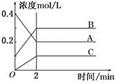
 2B(g)+C(g)
2B(g)+C(g)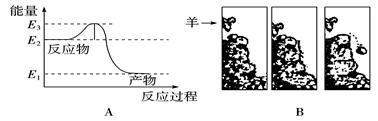
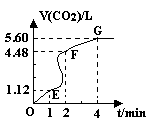 (气体体积均在标准状况下测定)。请回答下列问题:
(气体体积均在标准状况下测定)。请回答下列问题: (3)加入CaCO3的质量为 。
(3)加入CaCO3的质量为 。