题目内容
【题目】(1)联氨(N2H4)是二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为____(已知:N2H4+H+![]() N2H5+,K=8.7×107,Kw=1×10-14),联氨与硫酸形成的酸式盐的化学式为____。
N2H5+,K=8.7×107,Kw=1×10-14),联氨与硫酸形成的酸式盐的化学式为____。
(2)次磷酸(H3PO2)是一元中强酸,写出其电离方程式:_______。NaH2PO2溶液显_______(填“弱酸性”、“中性”或“弱碱性”)。
(3)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为_______mol·L-1。
(4)如图所示为二元酸H2A溶液中各微粒的物质的量分数(δ)随溶液pH的变化曲线(25C)。

H2A的电离平衡常数Ka1=_______,溶液pH=7时,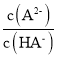 =______。
=______。
(5)25℃时,amolL-1氨水与0.01molL-1的盐酸等体积混合,若混合后所得溶液中c(NH4+)=c(Cl-)。用含a的代数式表示NH3·H2O的电离平衡常数Kb=_____。
【答案】8.7×10-7 N2H6(HSO4)2 H3PO2![]() H++H2PO2- 弱碱性 1.8×10-7 1×10-4.2 1×100.8
H++H2PO2- 弱碱性 1.8×10-7 1×10-4.2 1×100.8 ![]()
【解析】
(1)联氨(N2H4)是二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应方程式为:N2H4+H2O![]() N2H5++OH-,其电离平衡常数Kb=
N2H5++OH-,其电离平衡常数Kb=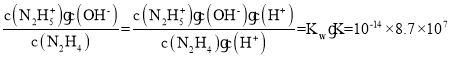 =8.7×10-7;联氨是二元弱碱,其与硫酸形成的酸式盐的化学式为N2H6(HSO4)2;
=8.7×10-7;联氨是二元弱碱,其与硫酸形成的酸式盐的化学式为N2H6(HSO4)2;
(2)次磷酸(H3PO2)是一元中强酸,说明分子中只含有1个-OH与P原子连接,其电离方程式为:H3PO2![]() H++H2PO2-;由于次磷酸是一元中强酸,所以NaH2PO2是强碱弱酸盐,在溶液中H2PO2-会发生水解反应,消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)>c(H+),但盐水解程度是微弱的,因此其水溶液显弱碱性;
H++H2PO2-;由于次磷酸是一元中强酸,所以NaH2PO2是强碱弱酸盐,在溶液中H2PO2-会发生水解反应,消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)>c(H+),但盐水解程度是微弱的,因此其水溶液显弱碱性;
(3)n(AgNO3)=0.05L×0.018mol/L=0.0009mol,n(HCl)=0.05L×0.020mol/L=0.001mol,硝酸银和HCl发生反应AgNO3+HCl=AgCl↓+HNO3,根据方程式知,HCl剩余,混合溶液中c(Cl-)=![]() =10-3mol/L,则根据AgCl的溶度积常数可知该溶液中c(Ag+)=
=10-3mol/L,则根据AgCl的溶度积常数可知该溶液中c(Ag+)=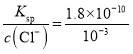 mol/L=1.8×10-7mol/L;
mol/L=1.8×10-7mol/L;
(4)H2A是二元弱酸,第一步电离方程式为H2A![]() H++HA-,Ka1=
H++HA-,Ka1= ,当c(HA-)=c(H2A)时,Ka1=c(H+)=1×10-4.2;H2A是二元弱酸,第二步电离方程式为HA-
,当c(HA-)=c(H2A)时,Ka1=c(H+)=1×10-4.2;H2A是二元弱酸,第二步电离方程式为HA-![]() H++A2-,Ka2=
H++A2-,Ka2=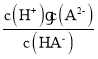 ,当溶液中c(HA-)=c(A2-)时,Ka2=c(H+)=
,当溶液中c(HA-)=c(A2-)时,Ka2=c(H+)=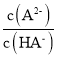 =1×10-6.2,当溶液pH=7时,c(H+)=10-7mol/L,则
=1×10-6.2,当溶液pH=7时,c(H+)=10-7mol/L,则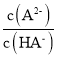 =(1×10-6.2)÷(1×10-7)=1×100.8;
=(1×10-6.2)÷(1×10-7)=1×100.8;
(5)所得混合溶液中c(NH4+)=c(Cl-),根据电荷守恒得c(OH-)=c(H+),根据物料守恒得c(NH3·H2O)=(0.5a-0.005)mol/L,根据水的离子积常数Kw=c(OH-)·c(H+)=10-14,溶液呈中性,c(OH-)=c(H+)=10-7mol/L,NH3H2O的电离常数Kb=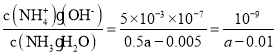 。
。