题目内容
【题目】(1)氯化铁水溶液呈___性,原因是(用离子方程式表示):___;把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是___;热的纯碱溶液去油污能力强,纯碱水解的离子方程式为___(写第一步即可)。
(2)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是___。
(3)已知:在相同条件下醋酸与氨水电离程度相同,现有浓度均为0.1mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水。
①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___;
④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)___。
【答案】酸 Fe3++3H2O![]() Fe(OH)3+3H+ Fe2O3 CO32-+H2O
Fe(OH)3+3H+ Fe2O3 CO32-+H2O![]() HCO3-+OH- 3HCO3-+Al3+=Al(OH)3↓+3CO2↑ ④、②、③、① ⑥、⑦、④、⑤、⑧
HCO3-+OH- 3HCO3-+Al3+=Al(OH)3↓+3CO2↑ ④、②、③、① ⑥、⑦、④、⑤、⑧
【解析】
(1)氯化铁溶液中的Fe3+发生水解,生成H+,水溶液呈酸性。答案为:酸
原因是Fe3++3H2O![]() Fe(OH)3+3H+。答案为:Fe3++3H2O
Fe(OH)3+3H+。答案为:Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
FeCl3溶液蒸干、灼烧过程中,HCl挥发,Fe(OH)3分解,最后Fe(OH)3全部转化为Fe2O3,所以得到的主要固体产物是Fe2O3。答案为:Fe2O3
热的纯碱溶液去油污能力强,纯碱水解的离子方程式为CO32-+H2O![]() HCO3-+OH-。
HCO3-+OH-。
答案为:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
(2)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,发生双水解反应,产生大量的气体CO2和沉淀Al(OH)3,气体将混合物压出灭火器,相关反应的离子方程式是3HCO3-+Al3+=Al(OH)3↓+3CO2↑。答案为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑
(3)对于①硫酸、②醋酸、③氢氧化钠、④氯化铵来说:
①硫酸、②醋酸、③氢氧化钠直接发生电离,生成H+或OH-,对水的电离产生抑制;④氯化铵,发生水解,对水的电离产生促进。
在①硫酸、②醋酸、③氢氧化钠中,相同浓度的①电离产生的c(H+)是③电离产生c(OH-)的二倍,①对水电离的影响最大,②电离程度最小,电离产生的c(H+)最小,所以对水电离的影响是①>③>②,故①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是④、②、③、①。答案为:④、②、③、①
对于④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水来说:
④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵发生水解,但即便是双水解,只要不能进行到底,水解的程度都是很少的,⑥中c(NH4+)是其它盐电离产生的c(NH4+)的二倍,所以⑥中c(NH4+)最大,⑦中硫酸氢铵电离出的H+将抑制c(NH4+)的水解,④中只发生c(NH4+)的水解,⑤中CH3COO-将促进c(NH4+)的水解,从而得出四种易水解的盐中c(NH4+)的关系为⑥>⑦>④>⑤;在氨水中,发生弱电解质的电离,但电离程度小,c(NH4+)小,故④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是⑥、⑦、④、⑤、⑧。
答案为:⑥、⑦、④、⑤、⑧

【题目】工业上用粗CuO粉末(含有Fe2O3和FeO杂质)制备纯净的CuCl2·xH2O晶体。
有关金属离子开始沉淀和沉淀完全时溶液的pH
离子 | Cu2+ | Fe2+ | Fe3+ |
开始沉淀pH | 5.4 | 8.1 | 2.7 |
沉淀完全pH | 6.9 | 9.6 | 3.7 |
制备方法如下:
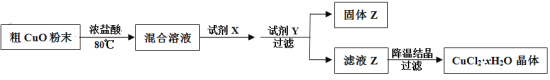
(1)加入试剂X的目的是将Fe2+氧化为Fe3+,试剂X是_______。
(2)加入试剂Y的目的是调节溶液的pH,试剂Y是______,调节pH的范围是_____,生成的固体Z是________。