题目内容
5.同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )| A. | 原子半径:X>Y>Z | B. | 单质的非金属性:X>Y>Z | ||
| C. | 气态氢化物稳定性:X<Y<Z | D. | 原子序数:X>Y>Z |
分析 同周期自左而右元素非金属性增强,非金属性越强,最高价氧化物对应水化物的酸性越强,最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,原子序数:X>Y>Z;同周期元素的原子从左到右,原子半径逐渐减小、氢化物的稳定性逐渐增强.
解答 解:非金属性越强,最高价氧化物对应水化物的酸性越强,最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,原子序数:X>Y>Z.
A.同周期从左到右非金属性增强,原子半径逐渐减小,所以原子半径:X<Y<Z,故A错误;
B.最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,故B正确;
C.非金属性越强,氢化物越稳定,由于非金属性X>Y>Z,所以气态氢化物的稳定性:HX>H2Y>ZH3,故C错误,
D.非金属性X>Y>Z,同周期从左到右元素非金属性增强,可知原子序数的关系为X>Y>Z,故D正确;
故选BD.
点评 本题考查元素周期律知识,题目难度不大,注意对元素周期律的理解掌握,有利于基础知识的巩固.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列名称的有机物实际上不可能存在的是( )
| A. | 3,3-二甲基-2-戊烯 | B. | 2-甲基-4-乙基-1-己烯 | ||
| C. | 3-甲基-2-戊烯 | D. | 2,2-二甲基丁烷 |
16.下列能级符号不正确的是( )
| A. | 1s | B. | 2d | C. | 3p | D. | 4f |
20.某化学课外学习小组对元素周期律和元素周期表进行研究和探讨,一部分同学提出了下列看法,你认为不正确的是( )
| A. | 原子的最外层有两个电子的元素并不都在第ⅡA族 | |
| B. | 第ⅠA族元素都是典型的金属元素 | |
| C. | 第ⅦA族的元素最外层都有七个电子 | |
| D. | 第三周期的元素的原子核外都有三个电子层 |
10. 先进的高能量密度二次电池对下一代电动汽车的发展和可再生能源发电的有效利用具有至关重要的作用.室温Al-Mn2O4二次电池是一种新型电池,由Al3+、Al2Cl7和${AlCl}_{4}^{-}$组成的离子液体为该电池的电解液,电池结构如图所示,放电时的总反应式为Al+Mn2O4═AlMn2O4.下列说法正确的是( )
先进的高能量密度二次电池对下一代电动汽车的发展和可再生能源发电的有效利用具有至关重要的作用.室温Al-Mn2O4二次电池是一种新型电池,由Al3+、Al2Cl7和${AlCl}_{4}^{-}$组成的离子液体为该电池的电解液,电池结构如图所示,放电时的总反应式为Al+Mn2O4═AlMn2O4.下列说法正确的是( )
 先进的高能量密度二次电池对下一代电动汽车的发展和可再生能源发电的有效利用具有至关重要的作用.室温Al-Mn2O4二次电池是一种新型电池,由Al3+、Al2Cl7和${AlCl}_{4}^{-}$组成的离子液体为该电池的电解液,电池结构如图所示,放电时的总反应式为Al+Mn2O4═AlMn2O4.下列说法正确的是( )
先进的高能量密度二次电池对下一代电动汽车的发展和可再生能源发电的有效利用具有至关重要的作用.室温Al-Mn2O4二次电池是一种新型电池,由Al3+、Al2Cl7和${AlCl}_{4}^{-}$组成的离子液体为该电池的电解液,电池结构如图所示,放电时的总反应式为Al+Mn2O4═AlMn2O4.下列说法正确的是( )| A. | 放电时,负极的电池反应式为AlMn2O4-3e-═Mn2O4+Al3+ | |
| B. | 放电时,Al3+向负极移动 | |
| C. | 充电时,Mn2O4极与电源的负极相连 | |
| D. | 充电时,Al电极质量增加 |
14.含有SiO2的黄铁矿试样1克,在O2中充分灼烧后残余固体为0.76克(设反应过程有2%的硫损失),用这种黄铁矿100吨可制得98%的浓硫酸的质量( )
| A. | 120吨 | B. | 117.6吨 | C. | 116吨 | D. | 121吨 |
14.下列说法正确的是( )
| A. | 天然气、液化石油气、沼气的主要成分均为甲烷 | |
| B. | 煤中含有苯、甲苯及多种化工原料,可通过煤的干馏获得 | |
| C. | 石油主要是各种烷烃、环烷烃、烯烃组成的混合物 | |
| D. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
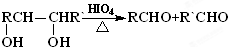
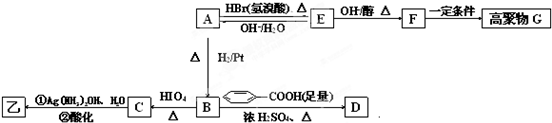
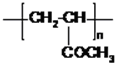 ;
;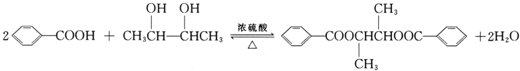 ;
;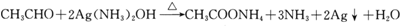 .
.