题目内容
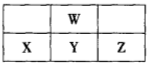
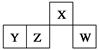
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )

| A.原子半径:rW>rZ>rY>rX |
| B.含Y元素的盐溶液一定显酸性 |
| C.最简单气态氢化物的热稳定性:Z>W |
| D.X与氢元素组成的化合物XH5与水反应可产生两种气体 |
D
试题分析:根据“短周期元素W原子的最外层电子数是最内层电子数的3倍”和四种元素的位置关系图说明W元素为硫元素,从而确定X为氮元素,Y为铝元素,Z为硅元素;A项原子半径大小正确关系为rY>rZ>rW>rX,错误;B项铝元素形成的偏铝酸盐水解能使溶液显碱性,错误;C项硫元素的非金属性比硅元素强,即氢化物的稳定性为H2S>SiH4,错误;D项NH5即为NH4H,与反应可生成NH3和H2,正确。

练习册系列答案
相关题目