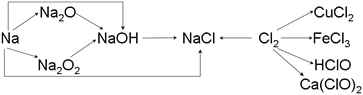
题目内容
【题目】用1000g溶剂中所含溶质的物质的量来表示的溶液浓度叫质量物质的量浓度,其单位是mol/kg。5mol/kg的硫酸的密度是1.29g/cm3,则其物质的量浓度是( )
A. 3.56mol/LB. 4.33mol/LC. 5.00mol/LD. 5.23mol/L
【答案】B
【解析】
根据信息可以知道,5molkg-1的硫酸表示1000g水溶解5molH2SO4,令水为1000g,则含有5mol H2SO4,计算溶液的质量,根据密度求出溶液体积,再利用c=n/V计算。
浓度为5molkg-1的硫酸,令水为1000g,则含有5mol H2SO4,所以m(H2SO4)=5mol×98g/mol=490g,所以溶液体积为=![]() =
=![]() mL;所以物质的量浓度为
mL;所以物质的量浓度为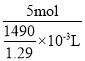 =4.33mol/L,故B正确;
=4.33mol/L,故B正确;
故答案选B。

【题目】实验室由间苯二酚合成2-硝基-1,3-苯二酚的原理如下:

已知:
物质 | 间苯二酚 | 2-硝基-1,3-苯二酚 |
熔点 | 109~112℃ | 84.85℃ |
沸点 | 276.5℃ | 234℃ |
溶解性 | 易溶于水 | 微溶于水 |
相对分子质量 | 110 | 155 |
实验药品:间苯二酚、浓硫酸(98%)、混合酸(由浓硝酸和浓硫酸按2:3的体积比混合而成)、尿素等。
实验步骤:
Ⅰ.称取2.7g间苯二酚粉末,放入100mL锥形瓶中,再加入13mL浓硫酸,同时充分搅拌,反应放热,立即生成白色磺化物。
Ⅱ.当反应物冷却后,用滴管滴加预先用冰水浴冷却好的混合酸,同时进行搅拌,并使反应温度不超过30℃.将生成的黄色粘稠状液体在室温下放置15min,再用7.5mL带有碎冰的冷水稀释,保持温度在50℃以下,得到红褐色的稠状液体。
Ⅲ.将反应液转移至250mL烧瓶中(如右下图所示,夹持和加热装置均已略去),再加入0.1g尿素,进行蒸馏,蒸馏液通过抽滤,洗涤干燥后,可得到橘红色片状晶体粗品。

试回答下列问题:
(1)进行产物蒸馏时,冷却水应从______(填“a”或“b”)口进入。
(2)实验过程中,温度控制在较低温度下进行的原因可能是:______。
(3)实验过程中配制混酸的正确操作是:______。
(4)加入尿素,其目的是使多余的硝酸和尿素反应而被除去。其中反应之一的化学方程式为:2CO(NH2)2+6HNO3=NH4NO3+8NO↑+2CO2↑+5H2O,若生成1.12LCO2(标准状况下)时,则转移的电子数为______。
(5)对粗品进行(方法)可提高产品纯度。若干燥后称量所得产品的质量为 2.1g,则其产率为______(保留两位小数)。