题目内容
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①NaHA溶液的pH___填大于、小于或等于)Na2A溶液的pH。
②某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是___。
A.c(H+)·c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
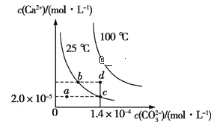
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有__。
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有__。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
④(CaA)的饱和溶液中存在平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0,加入Na2A固体,Ksp会___(填“变大”或“变小”或“不变”)
Ca2+(aq)+A2-(aq) ΔH>0,加入Na2A固体,Ksp会___(填“变大”或“变小”或“不变”)
(2)常温下,若在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=___mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
【答案】小于 BC BD 不变 2.2×10-8
【解析】
(1)①二元弱酸根离子第一步水解程度远远大于第二步水解程度;
②A.水的离子积常数与温度有关,温度越高,水的离子积常数越大;
B.溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性;
C.NaHA溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的物质的量应大于氢氧化钾的物质的量;
D.NaHA溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的体积应大于氢氧化钾的体积;
③根据平衡移动的影响因素进行判断;
④Ksp只与温度有关,与浓度无关;
(2)根据溶度积的概念可以直接计算。
(1)①二元弱酸根离子第一步水解程度远远大于第二步水解程度,水解程度越大,钠盐溶液碱性越强,所以NaHA溶液的pH小于Na2A溶液的pH;
②A.水的离子积常数与温度有关,温度越高,水的离子积常数越大,温度未知,所以水的离子积常数未知,选项A错误;
B.溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性,氢离子浓度等于氢氧根离子浓度,所以c(Na+)+c(K+)=c(HA-)+2c(A2-),选项B正确;
C.NaHA溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的物质的量应大于氢氧化钾的物质的量,所以同一混合溶液中c(Na+)>c(K+),选项C正确;
D.NaHA溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的体积应大于氢氧化钾的体积,所以c(Na+)+ c(K+)>0.05mol/L,选项D错误;
答案选BC;
③A、反应CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0为吸热反应,升高温度,平衡正向移动,Ca2+浓度增大,选项A不符合;
Ca2+(aq)+A2-(aq) ΔH>0为吸热反应,升高温度,平衡正向移动,Ca2+浓度增大,选项A不符合;
B、反应CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0为吸热反应,降低温度,平衡逆向移动,Ca2+浓度减小,选项B符合;
Ca2+(aq)+A2-(aq) ΔH>0为吸热反应,降低温度,平衡逆向移动,Ca2+浓度减小,选项B符合;
C、加入NH4Cl晶体,铵根离子水解促进A2-的水解,A2-浓度减小,平衡正向移动,Ca2+浓度增大,选项C不符合;
D、加入Na2A固体,A2-浓度增大,平衡逆向移动,Ca2+浓度减小,选项D符合;
答案选B D;
④Ksp只与温度有关,与浓度无关,当温度不变时,加入Na2A固体,Ksp不变;
(2)根据溶度积的概念可以直接计算。pH=8时,c(OH-)=10-6 mol/L,由c(Cu2+)·c2(OH-)=Ksp[Cu(OH)2]可得,c(Cu2+)=![]() =2.2×10-8 mol/L。
=2.2×10-8 mol/L。

【题目】(1)碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1 ℃时,测得各物质平衡时物质的量如下表:
活性炭(mol) | NO(mol) | A(mol) | B(mol) | |
初始 | 2.030 | 0.100 | 0 | 0 |
平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
在T1 ℃时,达到平衡共耗时2分钟,则NO的平均反应速率为________ mol·L-1·min-1;当活性炭消耗0.015 mol时,反应的时间________(填“大于”、“小于”或“等于”)1分钟。
(2)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
CH3OH(g)+H2O(g) ΔH<0。某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:

①该反应在0~8min时,CO2的转化率是________。
②仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。a、b、c、d四点中逆反应速率大小关系为_________,M、b、N三点中平衡常数K的大小关系是_______。
【题目】由硫铁矿烧渣(主要成分:Fe2O3、Al2O3、FeO、SiO2)制备绿矾(FeSO47H2O)的流程如下:

已知:①FeS2难溶于水,能还原Fe3+,硫元素被氧化成SO42-。
②金属离子生成氢氧化物沉淀的pH范围见下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.5 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 6.3 | 8.3 |
(1)滤渣Ⅰ的主要成分可与某种酸反应,其气态产物的电子式为____________;滤渣Ⅱ经灼烧后可用于_______(写出一种用途即可)。
(2)“还原”的目的是__________,写出“还原”步骤中涉及反应的离子方程式_________。
(3)“除铝”反应过程中控制的pH范围是_______________________。
(4)操作Ⅲ包含3个基本的实验操作,依次是_______________,“洗涤”时的试剂最好选用下列中的____________(填代号)
A.热水 B.氯水 C.乙醇 D.饱和食盐水
(5)设计实验检验制得的绿矾晶体中是否含有Fe3+:___________________________。