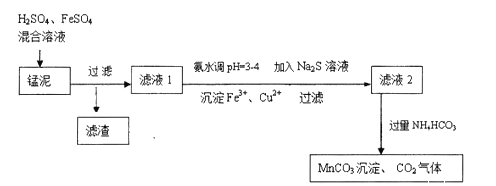
题目内容
【题目】臭氧(O3)能与KI溶液反应,生成氧气等。在反应后的溶液中滴入酚酞变为红色。若滴入淀粉则变为蓝色。为测定环境中空气的臭氧含量,将0℃、1.01×105Pa的空气33.6m3通过KI溶液,使反应完全,在所得溶液中用0.0100mol·L-1的Na2S2O3溶液60.0mL恰好滴定达终点,反应为:2Na2S2O3+I2→Na2S4O6+2NaI
(1)臭氧通入KI溶液中的化学方程式是________,每消耗1molO3,转移___mole-。
(2)计算大气中臭氧的体积分数___。(写出计算过程)
【答案】2KI+O3+H2O=2KOH+O2+I2 2 2.00×10-5%
【解析】
(1)臭氧(O3)通入KI溶液中,生成氧气,在反应后的溶液中滴入酚酞变为红色,则另一产物为KOH,从而写出反应的方程式;每消耗1molO3,只有1molO原子得电子,由0价降低为-2价,从而得出转移电子的物质的量。
(2)利用两个化学方程式,可以建立以下关系式:O3——I2——2Na2S2O3,代入数据,便可求出结果。
(1)臭氧(O3)通入KI溶液中,生成氧气、KOH和H2O,由此得出反应的方程式2KI+O3+H2O=2KOH+O2+I2;每消耗1molO3,只有1molO原子得电子,由0价降低为-2价,从而得出转移电子的物质的量为2mol。答案为:2KI+O3+H2O=2KOH+O2+I2;2;
(2)利用两个化学方程式,可以建立以下关系式:O3——I2——2Na2S2O3
设O3的物质的量为x,则:
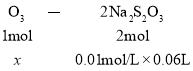
x=3×10-4mol,大气中臭氧的体积分数为![]() =2.00×10-5%。
=2.00×10-5%。
答案为:2.00×10-5%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目