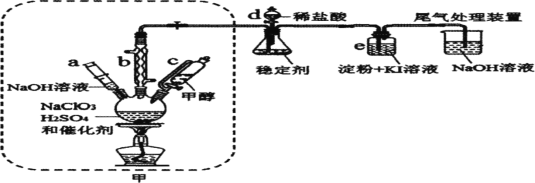
题目内容
【题目】A、B、C、D四种有机物分别由碳、氢、氧元素中的两种或三种元素组成各取四种有机物0.1mol,分别完全燃烧,均能得到4.48 L(标准状况下)二氧化碳,D的水溶液显酸性。四种有机物转化关系如图:
![]()
回答下列问题:
(1)A、D分子中所含官能团的名称分别是______、______。
(2)a mol A、B的混合气体完全燃烧,消耗氧气的体积为______(标准状况)。
(3)B→C的化学方程式________,反应类型______。
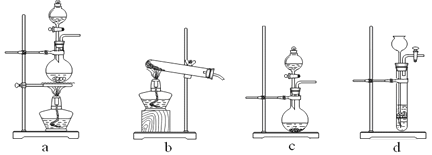
(4)在实验室里可以用如图所示的装置制取乙酸乙酯。

①写出用![]() 与乙酸发生酯化反应的化学方程式_________。
与乙酸发生酯化反应的化学方程式_________。
②反应开始前,试管乙中盛放的试剂为______,制乙酸乙酯时,试管甲中试剂加入顺序为______。
③合成乙酸乙酯的反应为放热反应,实验表明,反应温度应控制在85℃左右为宜。本实验温度不宜低于85℃左右的原因是________。
(5)对所得乙酸乙酯粗产品的提纯过程如下(已知:氯化钙与乙醇生成难溶物)。

图中操作Ⅰ的名称为_______,操作Ⅱ的名称为_______,操作Ⅲ的名称为_______。
【答案】碳碳双键 羧基 67.2aL 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 CH3COOH+C2H518OH
2CH3CHO+2H2O 氧化反应 CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O 饱和碳酸钠溶液 乙醇、浓硫酸、乙酸 温度低,反应速率低,且达不到催化剂活性温度,所以温度不能低于85℃ 分液 过滤 蒸馏
CH3CO18OC2H5+H2O 饱和碳酸钠溶液 乙醇、浓硫酸、乙酸 温度低,反应速率低,且达不到催化剂活性温度,所以温度不能低于85℃ 分液 过滤 蒸馏
【解析】
(1)![]() (3):0.1mol A、B、C、D四种有机物,分别完全燃烧,均能得到4.48 L(标准状况下)二氧化碳,则分子内均含有2个碳原子,按转化关系
(3):0.1mol A、B、C、D四种有机物,分别完全燃烧,均能得到4.48 L(标准状况下)二氧化碳,则分子内均含有2个碳原子,按转化关系![]() 知,D为连续氧化的产物, 且D的水溶液显酸性,则D乙酸、乙酸可由乙醛氧化所得,则C为乙醛、乙醇催化氧化得乙醛,则B为乙醇、乙烯与水在催化剂作用下发生加成反应得乙醇,则A为乙烯,据此回答;
知,D为连续氧化的产物, 且D的水溶液显酸性,则D乙酸、乙酸可由乙醛氧化所得,则C为乙醛、乙醇催化氧化得乙醛,则B为乙醇、乙烯与水在催化剂作用下发生加成反应得乙醇,则A为乙烯,据此回答;
(4)①结合反应机理写![]() 与乙酸发生酯化反应的化学方程式;
与乙酸发生酯化反应的化学方程式;
②反应开始前,试管乙中盛放的试剂为饱和碳酸钠溶液,制乙酸乙酯时,试管甲中试剂加入顺序要考虑实验安全;
③温度不宜低于85℃左右的原因从温度对速率的影响来分析回答;
(5)乙酸乙酯粗产品中含有可溶于水的乙醇、乙酸,用饱和食盐水洗涤,得互不相溶的两层液体,经分液后得到纯度较高的乙酸乙酯,残留的少量乙醇与氯化钙反应生成难溶物,经过滤后得纯度高的乙酸乙酯,再加入无水碳酸钾固体,可除去残留的水和乙酸,通过蒸馏,就可得乙酸乙酯,据此回答;
(1)据分析A、D分别为乙烯和乙酸,则A、D分子中所含官能团的名称分别是碳碳双键、羧基;
答案为:碳碳双键、羧基;
(2) 据分析A、B分别为乙烯和乙醇,1mol乙烯和乙醇分别燃烧时耗氧量均为3 mol,1mol乙烯和乙醇的混合气体燃烧时耗氧量也为3 mol,则 a mol A、B的混合气体完全燃烧,消耗氧气的体积为3a mol ×22.4L/ mol=67.2 a L(标准状况);
答案为:67.2 a L;
(3) 据分析B、C分别为乙醇和乙醛,则B→C的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,反应类型是氧化反应;
2CH3CHO+2H2O,反应类型是氧化反应;
答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;氧化反应;
2CH3CHO+2H2O;氧化反应;
(4)①酯化反应的机理是酸脱羟基醇去氢,则![]() 与乙酸发生酯化反应的化学方程式为CH3COOH+C2H518OH
与乙酸发生酯化反应的化学方程式为CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O;
CH3CO18OC2H5+H2O;
答案为:CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O;
CH3CO18OC2H5+H2O;
②反应开始前,试管乙中盛放的试剂为饱和碳酸钠溶液,便于除去粗产品中的乙酸和乙醇、形成互不相溶的两层液体;试管甲中试剂加入顺序要考虑实验安全,浓硫酸密度较大,溶于水放出大量的热,因此制取乙酸乙酯时,先加入乙醇,然后边振荡边加入浓硫酸,最后加入乙酸,以防止混合液体溅出,发生危险;
答案为:饱和碳酸钠溶液;乙醇、浓硫酸、乙酸;
③温度低,反应速率低,且达不到催化剂活性温度,所以温度不能低于85℃;
答案为:温度低,反应速率低,且达不到催化剂活性温度,所以温度不能低于85℃;
(5)据分析知,乙酸乙酯粗产品中含有杂质乙醇、乙酸,绝大多数杂质通过饱和食盐水洗涤、经分液后除去,故可得到纯度较高的乙酸乙酯,按信息,残留的少量乙醇与氯化钙反应生成难溶物,经过滤后,得纯度更高的乙酸乙酯,最后用无水碳酸钾固体除去残留乙酸并吸收水,通过蒸馏,就可得纯净的乙酸乙酯;
答案为:分液;过滤;蒸馏。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】滴定实验是化学学科中重要的定量实验。请回答下列问题:
I.酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
(1)该学生的实验操作如下:
a.用碱式滴定管取稀NaOH25.00mL,注入锥形瓶中,加入甲基橙做指示剂。
b.用待测定的溶液润洗碱式滴定管。
c.用蒸馏水洗干净滴定管。
d.取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
e.检查滴定管是否漏水。
f.另取锥形瓶,再重复操作一次。
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)__→c→__→__→d→__→___。
②某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
仪器A的名称是__;盐酸的体积读数:滴定前读数为__mL,滴定后读数为____mL;
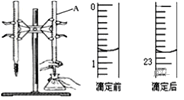
③在G操作中如何确定终点___。
(2)下列操作造成测定结果偏高的是___(填选项字母)
A.滴定终点时,俯视滴定管溶液液面
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
II.氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol/L的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
(1)滴定时,KMnO4溶液应装在___(“酸”或“碱”)式滴定管中,滴定终点时滴定现象是___。
(2)该草酸溶液的物质的量浓度为___。