题目内容
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用A12O3(熔点2045℃)和冰晶石(Na2AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(l)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)_______.
(2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是____________。
(3)下列关于氧化铝的叙述正确的是_______
A.氧化铝可以治疗胃酸过多。
B.氧化铝因为熔点高,可以作耐火材料.
C.氧化铝是铝热剂的成分之一。
D.氧化铝是两性氧化物,所以既能溶于盐酸又能溶于氨水。
(4)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3-。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为_________,此方法的缺点是处理后的水中生成了A1O3-,仍然可能对人类健康产生危害,还需要对该饮用水进行一系列后续处理。
已知25℃时,Ksp[Al(OH)3] = l.3×l0-33 Al(OH)3![]() AlO2-+H++H2O K=1.0×10-13
AlO2-+H++H2O K=1.0×10-13
25℃时,若欲使上述处理后的水中A1O2-浓度降到1.0×10-6mol/L,则应调节至pH=_______。
此时水中c(A13+)=__________
【答案】 4Al+3O2=2Al2O3在空气中铝的表面能够形成一层致密的氧化膜 NaF水解产生了HF,HF会腐蚀玻璃。 B ![]() 10Al+6NO3-+4OH-==3N2+10AlO2-+2H2O 7 1.3×10-12 mol·L一1
10Al+6NO3-+4OH-==3N2+10AlO2-+2H2O 7 1.3×10-12 mol·L一1
【解析】 (l)在空气中铝的表面能够形成一层致密的氧化膜,反应方程式为4Al+3O2=2Al2O3,形成的致密氧化膜能够阻止铝进一步被氧化,具有一定的抗腐蚀性,故答案为:4Al+3O2=2Al2O3在空气中铝的表面能够形成一层致密的氧化膜;
(2)氯化铝与氟化铵反应生成六氟合铝酸铵和氯化铵,方程式:AlCl3+NH4F=(NH4)3AlF6+3NH4Cl;氟化铵中的氟离子水解生成氢氟酸,氢氟酸能够与玻璃中二氧化硅反应,对玻璃有强烈的腐蚀性而对塑料则无腐蚀性,所以该实验所用试管及盛装NH4F溶液的试剂瓶均为塑料材质;故答案为:NaF水解产生了HF,HF会腐蚀玻璃;
(3)A.治疗胃酸过多是氢氧化铝,不是氧化铝,故A错误;B.氧化铝的熔点高,可以用作耐火材料,故B正确;C.氧化铝是铝热反应的产物之一,不是铝热剂的成分,故C错误;D.氧化铝能溶于盐酸但不能溶于氨水,故D错误;故选B。
(4)NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为![]() ,根据题干信息,反应物为:铝、NO3-、OH-,生成物为:N2、H2O、碱性条件下铝参加反应生成物还有AlO2-,反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,依据原子个数守恒、电荷守恒反应的离子方程式:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O;水中AlO2-浓度降到1.0×10-6molL-1,依据Al(OH)3
,根据题干信息,反应物为:铝、NO3-、OH-,生成物为:N2、H2O、碱性条件下铝参加反应生成物还有AlO2-,反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,依据原子个数守恒、电荷守恒反应的离子方程式:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O;水中AlO2-浓度降到1.0×10-6molL-1,依据Al(OH)3![]() AlO2-+H++H2O K=1.0×10-13,则c(H+)=
AlO2-+H++H2O K=1.0×10-13,则c(H+)=![]() =10-7(mol/L);pH=7,c(OH-)=10-7mol/L,25℃时,Ksp[Al(OH)3]=1.3×10-33,则c(Al3+)=
=10-7(mol/L);pH=7,c(OH-)=10-7mol/L,25℃时,Ksp[Al(OH)3]=1.3×10-33,则c(Al3+)=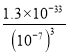 =1.3×10-12molL-1;故答案为:
=1.3×10-12molL-1;故答案为:![]() ;10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O;7;1.3×10-12molL-1。
;10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O;7;1.3×10-12molL-1。