题目内容
【题目】甲醇质子交换膜燃料电池中,将甲醇蒸气转化为氢气的两种反应原理有如下两种:①CH3OH(g)+H2O(g) = CO2(g)+3H2(g)ΔH = + 49.0 kJ·mol-1②CH3OH(g)+![]() O2(g) = CO2(g)+2H2(g) H = - 192.9 kJ·mol-1,下列说法正确的是( )
O2(g) = CO2(g)+2H2(g) H = - 192.9 kJ·mol-1,下列说法正确的是( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如图所示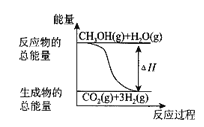
C.CH3OH转变成H2的过程一定要放出能量
D.根据②推知反应:CH3OH(l)+ ![]() O2(g) = CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g) = CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
【答案】D
【解析】
A、燃烧热是指完全燃烧1mol纯物质生成最稳定产物的过程中放出的热量,甲醇燃烧对应产物应该是二氧化碳气体和液态的水,不是氢气,故A错误;
B、根据图示内容知道:反应物的能量高于生成物的能量,则反应是放热的过程,而①是吸热的过程,故B错误;
C、根据热化学方程式②知道,甲醇转化为氢气的过程也可能是放热的,故C错误;
D、气体甲醇变为液态甲醇的过程是放热的过程,根据反应②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ·mol-1 知道,液态甲醇发生此反应放出的热量会小于192.9kJ,故D正确。
故选D。

练习册系列答案
相关题目
【题目】向如图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.X和Y可能是

A | B | C | D | |
X | NO2 | SO2 | HCl | Cl2 |
Y | 饱和NaOH溶液 | 饱和碳酸氢钠溶液 | 亚硫酸钠溶液 | 亚硫酸钠溶液 |
A.AB.BC.CD.D