题目内容
【题目】纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用.
(1)工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为、 . 某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1: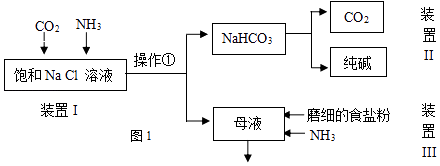
已知:几种盐的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
(2)①写出装置I中反应的化学方程式 . ②从平衡移动角度解释该反应发生的原因 .
③操作①的名称是 .
(3)写出装置II中发生反应的化学方程式 .
(4)请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用.
(5)该流程中可循环利用的物质是
(6)制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是 . a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4 , 干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量.
【答案】
(1)Ca(OH)2;Na2CO3
(2)NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl;在溶液中存在下述两种平衡NH3+H2O?NH3?H2O?NH4++OH﹣,CO2+H2O?H2CO3?H++HCO3﹣,OH﹣与H+结合生成水,促进两平衡正向移动,使溶液中的NH4+和HCO3﹣浓度均增大,由于NaHCO3溶解度小,因此HCO3﹣与Na+结合生成NaHCO3,固体析出使得反应发生;过滤
(3)2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(4)在母液中含有大量的NH4+和Cl﹣,存在平衡NH4Cl(s)?NH4++Cl﹣,通入氨气增大NH4+的浓度,加入磨细的食盐粉,增大Cl﹣的浓度,使上述平衡逆向移动,促使氯化铵结晶析出
(5)氯化钠和二氧化碳
(6)c
【解析】解:(1)工业上除去Mg2+用含有OH﹣的可溶性碱、除去Ca2+用含有CO32﹣的可溶性盐,且这两种试剂必须价格低廉,除去镁离子用氢氧化钙、除去钙离子用碳酸钠,所以答案是:Ca(OH)2;Na2CO3;(2)①NaCl、CO2、NH3、H2O发生反应生成NaHCO3和NH4Cl,反应方程式为NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl,所以答案是:NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl;
②在溶液中存在下述两种平衡NH3+H2ONH3H2ONH4++OH﹣,CO2+H2OH2CO3H++HCO3﹣,OH﹣与H+结合生成水,促进两平衡正向移动,使溶液中的NH4+和HCO3﹣浓度均增大,由于NaHCO3溶解度小,因此HCO3﹣与Na+结合生成NaHCO3,固体析出使得反应发生,所以答案是:在溶液中存在下述两种平衡NH3+H2ONH3H2ONH4++OH﹣,CO2+H2OH2CO3H++HCO3﹣,OH﹣与H+结合生成水,促进两平衡正向移动,使溶液中的NH4+和HCO3﹣浓度均增大,由于NaHCO3溶解度小,因此HCO3﹣与Na+结合生成NaHCO3,固体析出使得反应发生;③分离沉淀和溶液采用过滤方法,所以该操作名称是过滤,所以答案是:过滤;(3)受热条件下,碳酸氢钠分解生成碳酸钠、二氧化碳和水,反应方程式为2NaHCO3 ![]() Na2CO3+H2O+CO2↑,所以答案是:2NaHCO3
Na2CO3+H2O+CO2↑,所以答案是:2NaHCO3 ![]() Na2CO3+H2O+CO2↑;(4)在母液中含有大量的NH4+和Cl﹣,氯化铵存在溶解平衡,增大离子浓度抑制其溶解,所以在母液中含有大量的NH4+和Cl﹣,存在平衡NH4Cl(s)NH4++Cl﹣,通入氨气增大NH4+的浓度,加入磨细的食盐粉,增大Cl﹣的浓度,使上述平衡逆向移动,促使氯化铵结晶析出,所以答案是:在母液中含有大量的NH4+和Cl﹣,存在平衡NH4Cl(s)NH4++Cl﹣,通入氨气增大NH4+的浓度,加入磨细的食盐粉,增大Cl﹣的浓度,使上述平衡逆向移动,促使氯化铵结晶析出;(5)装置III中从母液中能分离出氯化钠,装置II中得到二氧化碳,装置I中需要二氧化碳和氯化钠,所以能循环利用的是氯化钠和二氧化碳,所以答案是:氯化钠和二氧化碳;(6)a.只有氯化钙能和碳酸钠反应生成碳酸钙,根据碳酸钙的量计算碳酸钠的量,所以该方案可以,故a不选;b.只有碳酸钠能和稀硫酸反应生成二氧化碳,根据二氧化碳的量计算碳酸钠的量,所以该方案可以,故b不选;c.碳酸根离子和氯离子都能和银离子反应生成白色沉淀,无法计算碳酸钠的量,所以该方案不可以,故c选;故选c.
Na2CO3+H2O+CO2↑;(4)在母液中含有大量的NH4+和Cl﹣,氯化铵存在溶解平衡,增大离子浓度抑制其溶解,所以在母液中含有大量的NH4+和Cl﹣,存在平衡NH4Cl(s)NH4++Cl﹣,通入氨气增大NH4+的浓度,加入磨细的食盐粉,增大Cl﹣的浓度,使上述平衡逆向移动,促使氯化铵结晶析出,所以答案是:在母液中含有大量的NH4+和Cl﹣,存在平衡NH4Cl(s)NH4++Cl﹣,通入氨气增大NH4+的浓度,加入磨细的食盐粉,增大Cl﹣的浓度,使上述平衡逆向移动,促使氯化铵结晶析出;(5)装置III中从母液中能分离出氯化钠,装置II中得到二氧化碳,装置I中需要二氧化碳和氯化钠,所以能循环利用的是氯化钠和二氧化碳,所以答案是:氯化钠和二氧化碳;(6)a.只有氯化钙能和碳酸钠反应生成碳酸钙,根据碳酸钙的量计算碳酸钠的量,所以该方案可以,故a不选;b.只有碳酸钠能和稀硫酸反应生成二氧化碳,根据二氧化碳的量计算碳酸钠的量,所以该方案可以,故b不选;c.碳酸根离子和氯离子都能和银离子反应生成白色沉淀,无法计算碳酸钠的量,所以该方案不可以,故c选;故选c.