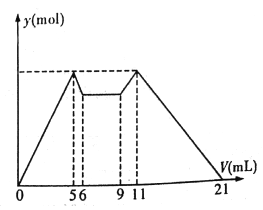
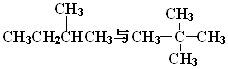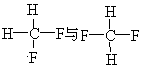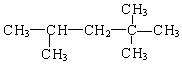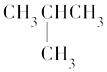题目内容
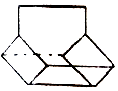
【题目】研究电化学腐蚀及防护的装置如图所示.下列有关说法正确的是( ) 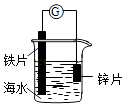
A.锌片发生氧化反应作阴极
B.电子从铁片经过导线流向锌片
C.铁片上电极反应为:O2+2H2O+4e→4OH﹣
D.该装置可用于研究外加电流阴极保护法
【答案】C
【解析】解:A、锌比铁片活泼,所以腐蚀锌,锌是负极,而不是阴极,故A错误;
B、电子从负极沿导线流向正极,所以电子从锌片经过导线流向铁片,故B错误;
C、铁为正极,发生吸氧腐蚀,电极反应式为O2+2H2O+4e﹣=4OH﹣,故C正确;
D、该装置可用于研究牺牲阳极的阴极保护法,而不是用于研究外加电流阴极保护法,故D错误;
故选C.
【考点精析】关于本题考查的金属的电化学腐蚀与防护,需要了解金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法才能得出正确答案.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用.
(1)工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为、 . 某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1: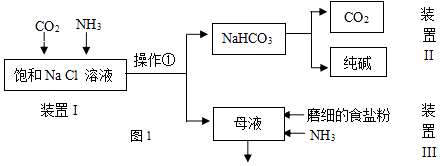
已知:几种盐的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
(2)①写出装置I中反应的化学方程式 . ②从平衡移动角度解释该反应发生的原因 .
③操作①的名称是 .
(3)写出装置II中发生反应的化学方程式 .
(4)请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用.
(5)该流程中可循环利用的物质是
(6)制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是 . a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4 , 干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量.
【题目】表为元素周期表的一部分:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
二 | C | N | ① | |||||
三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是(填写元素符号);①的核外电子排布式;③和⑥两元素形成化合物的电子式为 .
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是(填化学式).
(3)比较④、⑤两种元素的简单离子半径:>(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为 .
(4)列举一个事实来证明元素①比元素⑤的非金属性强 .
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式 .