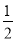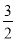题目内容
许多金属及它们的化合物在科学研究和工业生产中具有许多用途。
回答下列有关问题:
(1)基态Ni的核外电子排布式为__________________________________________,
第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________。
(2)配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=________,CO与N2结构相似,CO分子内σ键与π键个数之比为________。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同。
①Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
②NiO晶体中Ni的配位数为________。
(4)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是________________________________________________________________________________________________________________________________________________,
反应的离子方程式为________________________________________________________________________。
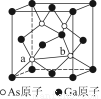
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为________,若该晶胞的边长为a pm,则合金的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(1)1s22s22p63s23p63d84s2 C(碳)
(2)4 1∶2
(3)①> ②6
(4)H2O2为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行 Cu+H2O2+4NH3=Cu(NH3)42++2OH-
(5)1∶3 
【解析】(1)Ni基态原子中未成对电子数为2,与之未成对电子数相同的第二周期元素为碳元素和氧元素,电负性最小的为碳元素。(2)Ni原子价电子数为10,配体CO可以提供一个孤电子对,则n= =4;氮氮三键中含有1个σ 键和2个π键,CO与N2结构相似,故CO分子内σ键与π键个数之比为1∶2。(3)①离子晶体中,在其他因素一样时,离子半径越小,离子键就越强,熔点越高;②NiO的晶体结构类型与氯化钠的相同,均为立方最密堆积,Ni原子与O原子的配位数均为6。(4)H2O2具有强氧化性,可以将Cu氧化为Cu2+,但反应速率很小,而氨与Cu2+形成配离子,两个反应相互促进使反应速率加快,反应得以进行。(5)Au原子位于顶点,则一个晶胞中含有Au原子数为8×
=4;氮氮三键中含有1个σ 键和2个π键,CO与N2结构相似,故CO分子内σ键与π键个数之比为1∶2。(3)①离子晶体中,在其他因素一样时,离子半径越小,离子键就越强,熔点越高;②NiO的晶体结构类型与氯化钠的相同,均为立方最密堆积,Ni原子与O原子的配位数均为6。(4)H2O2具有强氧化性,可以将Cu氧化为Cu2+,但反应速率很小,而氨与Cu2+形成配离子,两个反应相互促进使反应速率加快,反应得以进行。(5)Au原子位于顶点,则一个晶胞中含有Au原子数为8× =1,Cu原子位于面心,则一个晶胞中含有Cu原子数为6×
=1,Cu原子位于面心,则一个晶胞中含有Cu原子数为6× =3,故该合金中Au原子与Cu原子个数之比为1∶3;一个晶胞的质量为
=3,故该合金中Au原子与Cu原子个数之比为1∶3;一个晶胞的质量为 g,一个晶胞的体积为a3 pm3,故合金的密度为
g,一个晶胞的体积为a3 pm3,故合金的密度为 g·pm-3=
g·pm-3= g·cm-3。
g·cm-3。

 应用题作业本系列答案
应用题作业本系列答案(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO32—、SiO32—、AlO2—、Cl- |
阳离子 | Al3+、Cu2+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积(V)的关系如图所示。
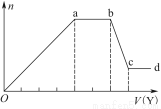
①若Y是盐酸,则溶液中含有的金属阳离子是_________________________________,
ab段发生反应的总离子方程式为___________________________________
表中Oa段与Y溶液反应的离子的物质的量之比为__________[要标明离子符号,如n(Na+)]。
②若Y是NaOH溶液,则bc段反应的离子方程式为______________________________
若不考虑离子的水解因素,忽略H+和OH-的影响,且溶液中只存在4种离子,则它们的离子个数比为___________________________________[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列]。
(2)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处。已知锡元素具有如下性质:
Sn4++Sn=2Sn2+;
2Sn2++O2+4H+=2Sn4++2H2O;
2H++SnO22— Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的离子方程式:______________________________________,
②将①中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)__________。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2, 该碱是__________。