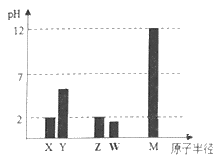
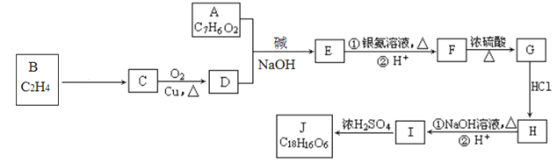
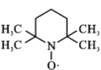
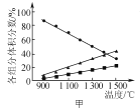
题目内容
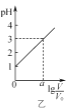
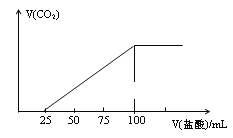
【题目】向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol·L-1的盐酸,产生CO2气体的体积与所加盐酸体积之间的关系如图所示。下列判断正确的是
A.所得溶液溶质成分的物质的量之比为:n(NaHCO3):n(Na2CO3)=2: 1
B.所得溶液溶质成分的物质的量之比为:(NaOH):n(Na2CO3)=1: 3
C.原NaOH溶液的浓度为0.1mol/L
D.通入CO2体积为448mL
【答案】A
【解析】
本题主要考查关于NaOH与CO2反应的计算。有关反应:Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+H2O+CO2↑。
A.由图象可知,混合物为碳酸钠和碳酸氢钠,混合物中滴加盐酸,由碳酸钠转化为碳酸氢钠,消耗25mL盐酸,则原有碳酸氢钠消耗100mL-25×2mL=50mL盐酸,所得溶液的溶质成分的物质的量之比为n(NaHCO3):n(Na2CO3)=50mL:25mL=2:1,故A正确;
B.根据A项分析,所得溶液的溶质成分为碳酸钠和碳酸氢钠,不含氢氧化钠,故B错误;
C.在加入100mL稀盐酸时,恰好生成氯化钠溶液,由原子守恒可知,原NaOH溶液的浓度为c=![]() =0.2mol/L,故C错误;
=0.2mol/L,故C错误;
D.温度和压强不确定,通入CO2的体积也无法确定,故D错误。
答案:A。

 口算能手系列答案
口算能手系列答案【题目】钛(Ti)被称为“未来金属”,广泛应用于国防、航空航天、生物材料等领域。钛的氯化物有如下转变关系:2TiCl3![]() TiCl4↑+TiCl2回答下列问题。
TiCl4↑+TiCl2回答下列问题。
(1)某同学所画基态 Cl-的外围电子排布图为![]() ,这违反了____________
,这违反了____________
(2)从结构角度解释 TiCl3中Ti(III)还原性较强的原因____________。
(3)钛的氯化物的部分物理性质如下表:
氯化物 | 熔点/℃ | 沸点/℃ | 溶解性 |
TiCl4 | -24 | 136 | 可溶于非极性的甲苯和氯代烃 |
TiCl2 | 1035 | 1500 | 不溶于氯仿、乙醚 |
①TiCl4与TiCl2的晶体类型分别是____________。
②TiCl4与SO42-互为等电子体,因为它们____________相同;SO42-中心原子以3s轨道和3p轨道杂化。
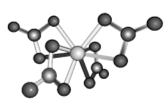
(4)Ti的配合物有多种。Ti(CO)6、Ti(H2O)63+、TiF62-的配体所含原子中电负性最小的是__________;Ti(NO3)4的球棍结构如图,Ti的配位数是_____________
(5)钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图:
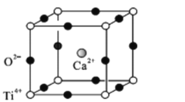
①设N为阿伏加德罗常数的值,计算一个晶胞的质量为______________g.
②假设O2-采用面心立方最密堆积,Ti4+与O2-相切,则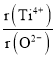 =_________。
=_________。