题目内容
8.表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
(2)写出BA4的电子式
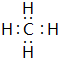 .
.(3)用电子式表示离子化合物E2D的形成过程
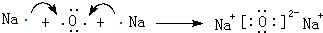 .
.(4)C和D两种元素氢化物的稳定性更强的是H2O(填物质的化学式).
分析 由元素在短周期中的位置,可知A为氢、B为碳、C为氮、D为氧、E为Na、F为Al、G为Cl.
(1)由F的位置可知,F处于第三周期ⅢA族;
(2)CH4分子中C原子与H原子之间形成1对共用电子对;
(3)Na2O由钠离子与氧离子构成,用Na原子、O原子电子式表示其形成;
(4)元素非金属性越强,其氢化物越稳定.
解答 解:由元素在短周期中的位置,可知A为氢、B为碳、C为氮、D为氧、E为Na、F为Al、G为Cl.
(1)由F的位置可知,F处于第三周期ⅢA族,故答案为:三、ⅢA;
(2)CH4分子中C原子与H原子之间形成1对共用电子对,其电子式为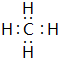 ,故答案为:
,故答案为: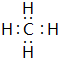 ;
;
(3)Na2O由钠离子与氧离子构成,用Na原子、O原子电子式表示其形成为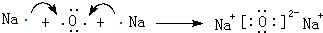 ,
,
故答案为: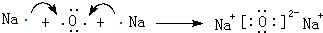 ;
;
(4)同周期自左而右非金属性增强,故非金属性O>N,元素非金属性越强,其氢化物越稳定,故氢化物稳定性H2O>NH3,故答案为:H2O.
点评 本题考查元素周期表与元素周期律综合应用,难度不大,需要学生熟练掌握元素周期表的结构,注意用电子式表示物质或化学键的形成.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
19.如表所示为部分短周期元素的原子半径及主要化合价 ,根据表中信息判断下列叙述不正确的是( )
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6.-2 | -1 | -1 |
| A. | 气态氢化物的稳定性HG>HF>H2E | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | A、E元素与氧元素可以形成三种常见的含氧酸盐 | |
| D. | C元素的原子最外层电子数等于电子层数 |
16.下列实验叙述或现象描述正确的是( )
| A. | 液溴易挥发,在存放液溴的试剂瓶中应加水封 | |
| B. | 常温下用铝制品贮运浓硫酸,常温下也可用钢瓶贮存干燥的Cl2,因为互相不发生反应 | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用;在空气中,镀锌铁板比铁板更耐腐蚀 | |
| D. | 高温下用焦炭还原SiO2制取粗硅;二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
3.分布在三个不同短周期的四种元素A、B、C、D的原子序数依次增大,其中B、C同周期,A、D同主族.常温下,BA3溶液的显碱性;C是地壳中含量最高的元素;D是所在周期原子半径最大的元素.下列说法正确的是( )
| A. | 原子半径:D>C>B>A | |
| B. | 气态氢化物的热稳定性:HmB>HnC | |
| C. | 由A、B、C三种元素形成的化合物均只含有共价键,不含离子键 | |
| D. | 单质D与水反应放出氢气,当转移2NA个电子时,产生氢气的体积为22.4升(标准状况) |
13.下列叙述是某同学利用教材中的一些数据作出的判断,其中正确的是( )
| A. | 利用焓变或熵变的数据一定都能单独判断反应的自发性 | |
| B. | 利用沸点数据推测一些液体混合物分离开来的可能性 | |
| C. | 利用反应热数据的大小判断不同反应的反应速率的大小 | |
| D. | 利用溶液的pH与7的大小关系来判断任何温度下溶液的酸碱性 |
20.下列联系实际的说法正确的是( )
| A. | 可燃冰就是固态甲烷 | |
| B. | 人类目前直接利用的能量大部分是由化学反应产生的 | |
| C. | 煤、石油、天然气都是可再生能源 | |
| D. | 硫和碳的氧化物是形成酸雨的主要物质 |
17.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,含NA个氩原子的氩气的体积约为11.2 L | |
| B. | 31g白磷分子中,含有的共价单键数目是NA个 | |
| C. | 6 g金刚石晶体中含有的碳碳键数目为2×6.02×1023 | |
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |



 .
. 、F
、F .
. (其中两种).
(其中两种).