题目内容
9.石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石.已知12g石墨完全转化成金刚石时,要吸收1.9kJ的能量.下列说法正确的是( )| A. | 石墨不如金刚石稳定 | |
| B. | 由金刚石制备石墨是吸热反应 | |
| C. | 等质量的石墨与金刚石完全燃烧,金刚石放出的能量更多 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量更多 |
分析 12g石墨完全转化成金刚石时,要吸收1.9kJ的能量,金刚石能量高,能量越低越稳定.
解答 解:A.12g石墨完全转化成金刚石时,要吸收1.9kJ的能量,金刚石能量高,石墨稳定,故A错误;
B.12g石墨完全转化成金刚石时,要吸收1.9kJ的能量;由金刚石制备石墨是放热反应,故B错误;
C.金刚石能量高燃烧放出能量高,等质量的石墨与金刚石完全燃烧,金刚石放出的能量更多,故C正确;
D.金刚石能量高燃烧放出能量高,等质量的石墨与金刚石完全燃烧,金刚石放出的能量更多,故D错误.
故选C.
点评 本题考查了化学反应的能量变化,物质能量高低与物质稳定性的关系,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.如表所示为部分短周期元素的原子半径及主要化合价 ,根据表中信息判断下列叙述不正确的是( )
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6.-2 | -1 | -1 |
| A. | 气态氢化物的稳定性HG>HF>H2E | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | A、E元素与氧元素可以形成三种常见的含氧酸盐 | |
| D. | C元素的原子最外层电子数等于电子层数 |
20.下列联系实际的说法正确的是( )
| A. | 可燃冰就是固态甲烷 | |
| B. | 人类目前直接利用的能量大部分是由化学反应产生的 | |
| C. | 煤、石油、天然气都是可再生能源 | |
| D. | 硫和碳的氧化物是形成酸雨的主要物质 |
17.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,含NA个氩原子的氩气的体积约为11.2 L | |
| B. | 31g白磷分子中,含有的共价单键数目是NA个 | |
| C. | 6 g金刚石晶体中含有的碳碳键数目为2×6.02×1023 | |
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
4.银锌纽扣电池的总反应式为Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
| A. | 锌做负极 | B. | 放电时,正极产物是银 | ||
| C. | 电解质溶液不可能呈酸性 | D. | 充电时发生了原电池反应 |
1.如图所示的实验操作,能达到相应目的是( )
| A. | 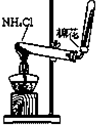 实验室制氯气 | B. |  检验K2CO3中的K+ | ||
| C. | 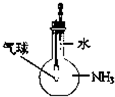 证明氨气吸易溶于水 | D. |  排水集气法收集NO |
19.在一个固定容积的密闭容器中,2molA和1molB发生反应2A(g)+B(g)?3C(g),达到平衡时,C的浓度为W mol/L.维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为W mol/L,该配比是( )
| A. | 4molA+2molB | B. | 1molA+0.5molB+1.5molC | ||
| C. | 3molC+1molB | D. | 3molC+2molA+1molB |



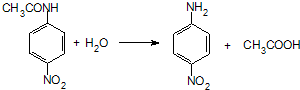 .
.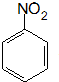 、F
、F .
. (其中两种).
(其中两种).