题目内容
1.短周期元素Q、W、Y原子序数依次增大,原子结构及性质如表所示:| 元素 | 结构与性质 |
| Q | Q元素的最高正、负价代数和为0.最高价氧化物为温室气体之一• |
| W | W是地壳中含量最高的非金属元素. |
| Y | Y所处的周期序数与主族序数相等,为地壳中含量最高的金属元素. |
(2)短周期中与W同主族元素的最高价氧化物的化学式SO3.
(3)元素Q的氧化物(溫室气体)、氢化物属于共价化合物(填“离子”、或“共价”),这些化合物分子内微粒间存在的作用力属于共价键(填离子键或共价键).
(4)单质Y可以发生如图所示的变化,回答:
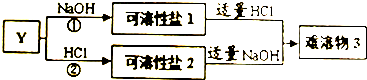
①写出反应①的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
②下列化合物可替代Y发生如图所示的变化的是AC(填选项).
A、Y2O3 B、Y2(SO4)3 C、Y(OH)3 D、Y(NO3)3
③写出难溶物3的化学式Al(OH)3.
分析 Q元素的最高正、负价代数和为0,其最高价氧化物为温室气体之一,则Q为C元素;W是地壳中含量最高的非金属元素,则W为O元素;Y所处的周期序数与主族序数相等,为地壳中含量最高的金属元素,则Y为Al,据此解答.
解答 解:Q元素的最高正、负价代数和为0,其最高价氧化物为温室气体之一,则Q为C元素;W是地壳中含量最高的非金属元素,则W为O元素;Y所处的周期序数与主族序数相等,为地壳中含量最高的金属元素,则Y为Al.
(1)Y为Al元素,处于周期表中第三周期ⅢA族,故答案为:第三周期ⅢA族;
(2)短周期中与W同主族元素为S元素,它的最高价氧化物的化学式为:SO3,故答案为:SO3;
(3)元素Q的氧化物(温室气体)为CO2、氢化物为CH4,属于共价化合物,这些化合物分子内微粒间存在的作用力属于共价键,故答案为:共价;共价键;
(4)①反应①是Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
②Al2O3、Al(OH)3属于两性化合物,可以代替Al发生图中转化关系,故答案为:AC;
③由转化关系可知,难溶物3是Al(OH)3,故答案为:Al(OH)3.
点评 本题考查结构性质位置关系应用,题目难度不大,注意对基础知识的理解掌握.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
15.某无色溶液与铝反应放出氢气,该溶液肯定不能大量共存的离子组是( )
| A. | Cl-,Mg2+,K+,SO42- | B. | NH4+,Cl-,Na+,Ba2+ | ||
| C. | Fe2+,NO3-,Cl-,Na+ | D. | HCO3-,K+,NH4+,SO42- |
12.与Na+具有相同质子数和电子数的微粒是( )
| A. | CH4 | B. | NH4+ | C. | Cl- | D. | OH- |
9.下列事实中不能证明CH3COOH是弱电解质的是( )
| A. | 常温下CH3COONa某溶液的pH=8 | |
| B. | 用CH3COOH溶液做导电实验,灯泡很暗 | |
| C. | 等pH等体积的盐酸、CH3COOH溶液分别与足量锌反应,CH3COOH放出的氢气较多 | |
| D. | 0.1mol•L-1的CH3COOH溶液中含有CH3COOH、CH3COO-、H+、OH- |
13.下列有关金属及其化合物的知识说法正确的是( )
| A. | 观察焰色反应实验为黄色火焰,则可证明该溶液中含有Na+ | |
| B. | 金属单质导电与电解质溶液导电原因是一样的 | |
| C. | 常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸 | |
| D. | 可用Na与MgCl2溶液反应制Mg |
10.63Li和73Li是锂的两种稳定同位素,在地质学和地球化学研究中有着广阔的应用前景.下列说法正确的是
( )
( )
| A. | 63Li和73Li是同一种核素 | B. | 63Li和73Li的中子数相同 | ||
| C. | 63Li和73Li的电子数相差1 | D. | 63Li和73Li的质子数相同 |
11.下列关于SiO2和CO2的叙述中不正确的是( )
| A. | SiO2的熔点比CO2高 | |
| B. | SiO2用于制光导纤维,干冰用于人工降雨 | |
| C. | 都能与水反应生成相应的酸 | |
| D. | 都能与强碱溶液反应 |
 某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.
某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.
 ,该反应的原子利用率为100%,其化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$2
,该反应的原子利用率为100%,其化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$2
 .
.