题目内容
1.25℃时,将pH=2的CH3COOH溶液和pH=12的NaOH溶液等体积混合后溶液pH=a,以下关于所得溶液的关系式肯定错误的是( )| A. | a>7 | B. | c(CH3COOH)-c(OH-)>10-amol/L | ||
| C. | c(Na+)=c(CH3COOH)+c(CH3COO-) | D. | c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
分析 CH3COOH为弱酸,在25℃时将pH=12的NaOH溶液中氢氧化钠浓度为0.01mol/L,而pH=2的CH3COOH溶液中醋酸的浓度大于0.01mol/L,两溶液等体积混合时,醋酸过量,溶液呈酸性,则:c(H+)>c(OH-),所以a<7;结合电荷守恒可得:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),
由于醋酸过量,则c(Na+)<c(CH3COOH)+c(CH3COO-),
根据以上分析进行判断.
解答 解:CH3COOH为弱酸,在25℃时将pH=12的NaOH溶液中氢氧化钠浓度为0.01mol/L,而pH=2的CH3COOH溶液中醋酸的浓度大于0.01mol/L,两溶液等体积混合时,醋酸过量,溶液呈酸性,则:c(H+)>c(OH-),所以a<7,
A.反应后醋酸过量,溶液显示酸性,所以容易的pH=a<7,故A错误;
B.反应后溶液中的氢离子为醋酸电离的,氢氧根离子浓度较小,且醋酸只能部分电离,则一定满足:c(CH3COOH)-c(OH-)>10-amol/L,故B正确;
C.由于反应后醋酸过量,根据电荷守恒可知:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),溶液中还存在醋酸分子,则c(Na+)<c(CH3COOH)+c(CH3COO-),故C错误;
D.根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故D正确;
故选AC.
点评 本题考查了离子浓度大小比较,题目难度中等,明确弱电解质在溶液中部分电离为解答关键,注意反应后醋酸过量,溶液显示酸性,为易错点,注意电荷守恒、物料守恒在判断离子浓度大小中的应用方法.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
11.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
| A. | 放电时负极反应为:Zn-2e-+2OH--Zn(OH)2 | |
| B. | 放电时正极发生氧化反应 | |
| C. | 放电时每转移2mol电子,反应的锌的质量是65g | |
| D. | 放电时化学能转化为电能 |
12.下列元素的最高价氧化物溶于水,形成的含氧酸的酸性最强的是( )
| A. | 原子最外层电子数是次外层电子数2倍的元素 | |
| B. | 原子M层电子数等于L层和K层电子数之差的元素 | |
| C. | 第三周期ⅦA族的元素 | |
| D. | 最高正价和最低负价的绝对值之差为2的元素 |
9.将5.4g Al投入200.0mL 2.0mol•L-1的某溶液中有H2产生,充分反应后有金属剩余.该溶液可能为( )
| A. | HNO3溶液 | B. | NaOH溶液 | C. | H2SO4溶液 | D. | 盐酸 |
6.下列各实验操作中,可能观察不到溶液产生浑浊现象的是( )
| A. | 氧气通入氢硫酸 | B. | H2S缓慢通入饱和氯水 | ||
| C. | H2S缓慢通入亚硫酸 | D. | SO2缓慢通入氢硫酸 |
10.下列表示对应化学反应的离子方程式,其中正确的是( )
| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | NaHSO4溶液中加入Ba(OH)2溶液至SO42完全沉淀:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | (NH4)2Fe(SO4)2溶液中加入过量的氢氧化钡溶液:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- |
15.将一直流电源的正、负极,用玻璃片分别压在一张用食盐水、碘化钾淀粉溶液和石蕊试液浸透的滤纸上,经过一段时间后,两极附近滤纸的颜色分别是( )
| A | B | C | D | |
| 阳极 | 蓝 | 白 | 红 | 蓝 |
| 阴极 | 白 | 蓝 | 蓝 | 蓝 |
| A. | A | B. | B | C. | C | D. | D |
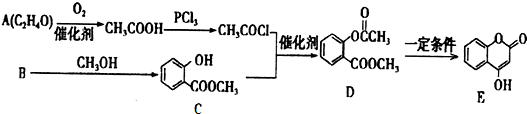
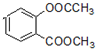 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O.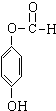
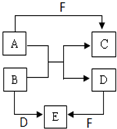 由短周期元素组成的中学常见的物质A、B、C、D、E、F的转化关系如图所示(部分反应条件略去):
由短周期元素组成的中学常见的物质A、B、C、D、E、F的转化关系如图所示(部分反应条件略去):