题目内容
某充电电池的原理如图所示,溶液中c(H+)="2.0" mol·L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是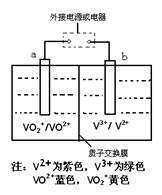
| A.放电过程中,左槽溶液颜色由黄色变为蓝色 |
| B.充电时,b极接直流电源正极,a极接直流电源负极 |
| C.充电过程中,a极的反应式为:VO2++2H++e—= VO2+ +H2O |
| D.放电时,当转移1.0 mol电子时共有1.0 mol H+从左槽迁移进右槽 |
A
解析试题分析:A、当右槽溶液颜色由绿色变为紫色时,该电极上得电子发生还原反应,所以电池中能量转化形式为电能转化为化学能,错误; B、充电过程中,a极是电解池阳极,a极的反应式为VO2+-e-+H2O=VO2++2H+,正确; C、储能电池a、b两极间的电解质溶液中通过阴阳离子的定向移动形成闭合回路,错误; D.放电时,a极是原电池正极,b极是原电池负极,电解质溶液中阳离子向正极移动,所以氢离子移向左槽,故D错误;
考点定位:本题考查化学新型电池,根据原电池和电解池原理来分析解答,注意原电池放电时电解质溶液中阴阳离子的移动方向,为易错点。

 阅读快车系列答案
阅读快车系列答案某同体酸燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是
| A.电子通过外电路从a极流向b极 |
| B.b极上的电极反应式为:O2+4H++4e-=2H2O |
| C.每转移0.4 mol电子,生成3.6g水 |
| D.H+由b极通过固体酸电解质传递到a极 |
下图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液。已知放电时电池反应为:Pb + PbO2 + 4H++ 2SO42—=2PbSO4 + 2H2O,下列有关说法正确的是
| A.K与N相接时,能量由电能转化为化学能 |
| B.K与N相接时,H+向负极区迁移 |
| C.K与M连接时,所用电源的a极为负极 |
| D.K与M相接时,阳极附近的pH逐渐减小 |
利用下图密封装置进行实验,起初a、b两处液面相平,放置一段时间。下列说法正确的是
| A.a中发生析氢腐蚀,b中发生吸氧腐蚀 |
| B.一段时间后,a中液面低于b中液面 |
| C.a中溶液的pH增大,b中溶液的pH减小 |
| D.a、b中负极的电极反应式均为Fe-2e-=Fe2+ |
有关下列①~④四个装置的描述正确的是
| A.装置①工作时溶液中OH—向阳极移动,因此阳极附近溶液先变红色 |
| B.装置②中Zn作正极,Cu作负极 |
| C.根据装置③可实现对铁制品表面镀铜 |
| D.根据装置④可实现对铁闸门保护 |
用石墨作电极,电解1 mol / L下列物质的溶液,溶液的pH值保持不变的是
| A.HCl | B.NaOH | C.K2SO4 | D.NaCl |
实验装置如图所示。下列说法正确的是
| A.该装置不能发生原电池反应 |
| B.活性炭是阴极 |
| C.总反应为:4Al+3O2 +6H2O → 4Al(OH)3 |
| D.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是( )。
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
