题目内容
下列实验装置,其中按要求设计正确的是 
B
解析试题分析:A、Fe做阳极本身失电子,不再是溶液中的Cl-失电子;B、可形成原电池Zn在负极失电子,Cu2+得电子在正极析出;C、电镀银时应选AgNO3做电解质溶液;D、电解精炼铜选取粗铜做阳极,粗铜失电子,Cu2+在阴极得电子析出附着在纯铜上。
考点:考查电解池,考查考生分析电极反应的能力。

练习册系列答案
相关题目
SO2通过下列工艺流程可制化工业原料H2SO4和清洁能源H2。
下列说法中正确的是
| A.电解槽中也可以用铁电极代替石墨作为阳极 |
| B.原电池中负极的电极反应为:SO2+2H2O+4e-=SO42-+4H+ |
| C.该工艺流程用总反应的化学方程式表示为:SO2+Br2+2H2O=2HBr+H2SO4 |
| D.该生产工艺的优点Br2被循环利用,原电池产生的电能可充分利用,还能获得清洁能源 |
下列有关钢铁的腐蚀和防护的说法中正确的是
| A.钢铁的析氢腐蚀和吸氧腐蚀负极反应相同,正极反应不同 |
| B.镀锌铁皮和镀锡铁皮破损后,前者更易被腐蚀 |
| C.将铁件与电源正极相连,可实现电化学保护 |
| D.将钢管与铜管堆放在一起,可保护钢管少受腐蚀 |
右图是一电池,下列有关说法正确的是
A.该电池负极反应为:2Fe2+-2e- 2Fe3+ 2Fe3+ |
| B.当有6.02×1023电子转移时,Fe电极减少56g |
| C.石墨电极上发生氧化反应 |
| D.盐桥中K+移向FeCl3溶液 |
一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:
CH3CH2OH + O2=== CH3COOH + H2O。下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 |
| C.负极上的反应为:CH3CH2OH-4e-+ H2O ===CH3COOH + 4H+ |
| D.正极上发生的反应为:O2 + 4e- + 2H2O ===4OH- |
电解加工是利用电解原理使金属在电解液中溶蚀成预定形状的方法。电解加工一铜构件的示意图如下:
阳极铜件被溶蚀,而阴极的质量和形状都保持不变,则原始电解液不宜含有大量的
| A.SO42— | B.Cl— | C.Na+ | D.Cu2 + |
某充电电池的原理如图所示,溶液中c(H+)="2.0" mol·L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是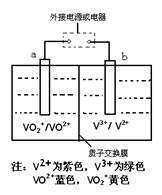
| A.放电过程中,左槽溶液颜色由黄色变为蓝色 |
| B.充电时,b极接直流电源正极,a极接直流电源负极 |
| C.充电过程中,a极的反应式为:VO2++2H++e—= VO2+ +H2O |
| D.放电时,当转移1.0 mol电子时共有1.0 mol H+从左槽迁移进右槽 |
观察下列几个装置示意图,有关叙述正确的是
| A.装置①中阳极上析出红色固体 |
| B.装置②中铜片应与电源负极相连 |
| C.装置③中外电路电流方向:b极 →a极 |
| D.装置④中阴极反应:2 Cl--2e-= Cl2 |
对下列装置的叙述错误的是 
| A.X如果是HCl,则不论a和b用导线连接还是a和b分别连接直流电源正、负极时,H+的移动方向均相同 |
| B.X如果是硫酸铜,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 |
| C.X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应 |
| D.X如果是NaCl,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 |