题目内容
某同体酸燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是
| A.电子通过外电路从a极流向b极 |
| B.b极上的电极反应式为:O2+4H++4e-=2H2O |
| C.每转移0.4 mol电子,生成3.6g水 |
| D.H+由b极通过固体酸电解质传递到a极 |
D
解析试题分析:A、a通入氢气为负极,b通入氧气是正极,则电子应该是通过外电路由a极流向b,正确;B、该电池电解质为Ca(HSO4)2固体,正极电极反应为O2+4e-+4H+=2H2O,正确;C、根据化学反应方程式可知:H2O—2e?,则每转移0.4 mol电子,生成0.2mol水,质量是0.2mol×18g/mol=3.6g,正确;D、原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,错误。
考点:本题考查燃料电池的工作原理和计算。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为
| A.M>Z>X>Y | B.X>Y>Z>M | C.X>Z>Y>M | D.X>Z>M>Y |
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3↓ |
| B.2Fe+2H2O+O2=2Fe(OH)2↓ |
| C.2H2O+O2+4e-=4OH- |
| D.Fe-3e-=Fe3+ |
SO2通过下列工艺流程可制化工业原料H2SO4和清洁能源H2。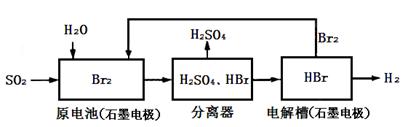
下列说法中正确的是
| A.电解槽中也可以用铁电极代替石墨作为阳极 |
| B.原电池中负极的电极反应为:SO2+2H2O+4e-=SO42-+4H+ |
| C.该工艺流程用总反应的化学方程式表示为:SO2+Br2+2H2O=2HBr+H2SO4 |
| D.该生产工艺的优点Br2被循环利用,原电池产生的电能可充分利用,还能获得清洁能源 |
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+) ( )
| A.阳极发生还原反应,其电极反应式:Ni2++2e-= Ni |
| B.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
| C.电解过程中,阳极质量的减少与阴极质量的增加不相等 |
| D.电解后,电解槽底部的阳极泥中只有Pt |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd +2NiOOH +2H2O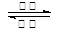 Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
有关该电池的说法正确的是
| A.放电时负极得电子,质量减轻 |
| B.放电时电解质溶液中的OH-向负极移动 |
| C.充电时阳极与外加电源的负极相连 |
| D.充电时阴极发生氧化反应 |
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是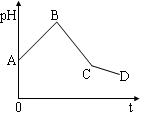
| A.阳极产物一定是Cl2,阴极产物一定是Cu |
| B.BC段表示在阴极上是H+放电产生了H2 |
| C.整个过程中阳极先产生Cl2,后产生O2 |
| D.CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+ |
下列有关钢铁的腐蚀和防护的说法中正确的是
| A.钢铁的析氢腐蚀和吸氧腐蚀负极反应相同,正极反应不同 |
| B.镀锌铁皮和镀锡铁皮破损后,前者更易被腐蚀 |
| C.将铁件与电源正极相连,可实现电化学保护 |
| D.将钢管与铜管堆放在一起,可保护钢管少受腐蚀 |
某充电电池的原理如图所示,溶液中c(H+)="2.0" mol·L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是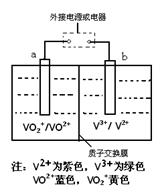
| A.放电过程中,左槽溶液颜色由黄色变为蓝色 |
| B.充电时,b极接直流电源正极,a极接直流电源负极 |
| C.充电过程中,a极的反应式为:VO2++2H++e—= VO2+ +H2O |
| D.放电时,当转移1.0 mol电子时共有1.0 mol H+从左槽迁移进右槽 |