题目内容
0.01mol的Na2CO3加入pH=1的100ml H2SO4溶液中,充分反应后向混合液中加入1.22g的BaCl2·xH2O,Ba2+恰好完全沉淀,则x的值是( )
| A.8 | B.6 | C.4 | D.2 |
D
化学计算能更好的考查学生的分析问题,解决问题的能力。本题学生只有分析清楚了反应的实际过程才能顺利的得出答案。
n(CO32-)=0.01mol、n(H+)=0.01mol,二者恰好生成0.01mol HCO3-,加BaCl2·xH2O生成沉淀只能是BaSO4,因为是恰好沉淀,所以n(Ba2+)=n(SO42-)=0.005mol,所以n(BaCl2·xH2O)=0.005mol,M(BaCl2·xH2O)= =244g/mol,x=
=244g/mol,x=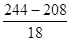 =2
=2
n(CO32-)=0.01mol、n(H+)=0.01mol,二者恰好生成0.01mol HCO3-,加BaCl2·xH2O生成沉淀只能是BaSO4,因为是恰好沉淀,所以n(Ba2+)=n(SO42-)=0.005mol,所以n(BaCl2·xH2O)=0.005mol,M(BaCl2·xH2O)=
 =244g/mol,x=
=244g/mol,x=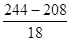 =2
=2
练习册系列答案
相关题目
 ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表: