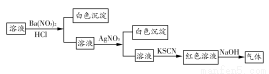
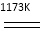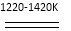题目内容
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

| 溶质的物质的量 浓度(mol·L-1) | 溶液的密度(g·cm-3) |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为 (不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为 mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与 c2 mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度
c2 mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度  c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
(1)  % (2)c1/2 (3)大于 大于
% (2)c1/2 (3)大于 大于
【解析】(1)设硫酸的体积为1 L,则w(H2SO4)=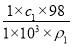 ×100%=
×100%= %
%
(2)硫酸与水等体积混合(忽略溶液体积的变化),溶液的体积变为原来的2倍,则浓度为 mol/L。
mol/L。
(3)根据图象可知,氨水的浓度越大,密度越小,则c2 mol/L氨水的密度小于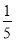 c2 mol/L氨水的密度,等质量时,
c2 mol/L氨水的密度,等质量时, c2 mol/L氨水的体积小于c2 mol/L氨水的体积。两者混合后,所得溶液的密度一定比ρ2大,所得溶液的物质的量浓度趋近于体积大者,故大于
c2 mol/L氨水的体积小于c2 mol/L氨水的体积。两者混合后,所得溶液的密度一定比ρ2大,所得溶液的物质的量浓度趋近于体积大者,故大于 c2 mol/L。
c2 mol/L。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目