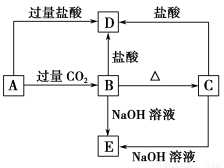
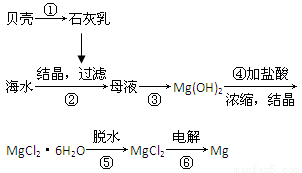
题目内容
某研究性学习小组就Na2O2的有关性质探究如下:向滴有酚酞的水中投入一定量的Na2O2,观察到先有大量气泡产生,溶液变红,过一会儿溶液又变为无色。
对上述实验中溶液变红,过一会儿又褪色的原因,甲、乙两同学提出了不同的解释:
甲同学认为是Na2O2与水反应放出氧气,氧气有氧化性,将酚酞氧化而使溶液褪色;
乙同学则认为是Na2O2与水反应时产生了H2O2,H2O2的强氧化性使酚酞褪色。
(1)乙同学设计了如下实验来证明自己的猜想是正确的:在滴有酚酞的氢氧化钠溶液中滴加3%的H2O2溶液并振荡。
①若乙同学的猜想正确,可观察到的现象是 。
②甲同学针对乙同学的上述验证实验提出还应增做实验才能更直接证明Na2O2与水反应生成了H2O2,甲同学提出要增加的实验是什么?
(2)试设计简单实验证明甲同学的解释是否正确(画出简易装置图,说明简要步骤)。
(1)①溶液的红色褪去
②在滴有酚酞的水中加入足量过氧化钠,待反应完成后向溶液中加入少量二氧化锰粉末,有气体放出,证明过氧化钠与水反应时有H2O2生成。
(2)向滴有酚酞的氢氧化钠溶液中通入氧气,若红色褪去,证明甲同学的推测正确,反之,则不正确。实验装置图如图所示(可用广口瓶等其他仪器代替烧杯,合理即可)
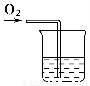
【解析】(1)①溶液的红色褪去,是因为H2O2有漂白性,能漂白酚酞。②H2O2在MnO2催化作用下能放出氧气,可在加入过氧化钠后的水溶液中加入少量MnO2,有气泡放出可直接证明过氧化钠与水反应有H2O2生成。(2)如果要验证是氧气能氧化酚酞,则可向滴有酚酞的氢氧化钠溶液中直接通入氧气来检验。

已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

| 溶质的物质的量 浓度(mol·L-1) | 溶液的密度(g·cm-3) |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为 (不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为 mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与 c2 mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度
c2 mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度  c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。