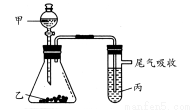
题目内容
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
A.1:4 B.1:2 C.2:1 D.4:1
B
【解析】由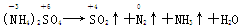 知,1 mol氮原子参加氧化反应失去了3 mol e-,1 mol硫原子参加还原反应得到2 mol e-;又因为(NH4)2SO4中,n(N):n(S)=2:1,在强热下分解,根据氧化还原反应得失电子数相等,发生氧化还原反应化合价变化的n(N):n(S)=2:3,若(NH4)2SO4中含S原子3 mol,那么含氮原子应为3×2 mol,故化合价发生变化和未发生变化的N原子数之比为2:(3×2-2)=1:2,B项正确。
知,1 mol氮原子参加氧化反应失去了3 mol e-,1 mol硫原子参加还原反应得到2 mol e-;又因为(NH4)2SO4中,n(N):n(S)=2:1,在强热下分解,根据氧化还原反应得失电子数相等,发生氧化还原反应化合价变化的n(N):n(S)=2:3,若(NH4)2SO4中含S原子3 mol,那么含氮原子应为3×2 mol,故化合价发生变化和未发生变化的N原子数之比为2:(3×2-2)=1:2,B项正确。

练习册系列答案
相关题目
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

| 溶质的物质的量 浓度(mol·L-1) | 溶液的密度(g·cm-3) |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为 (不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为 mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与 c2 mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度
c2 mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度  c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。