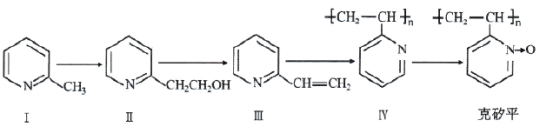
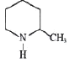
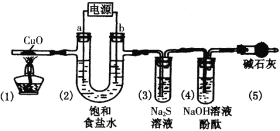
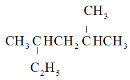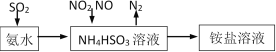题目内容
【题目】室温下,向![]() 盐酸中滴加
盐酸中滴加![]() 溶液,溶液的
溶液,溶液的![]() 随
随![]() 溶液体积的变化如图。已知
溶液体积的变化如图。已知![]() 下列说法不正确的是( )
下列说法不正确的是( )
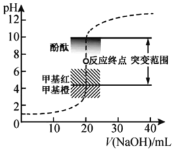
A.![]() 与盐酸恰好完全反应时,溶液
与盐酸恰好完全反应时,溶液![]()
B.![]() 时,溶液
时,溶液![]()
C.![]() 标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钾标定
标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钾标定![]() 溶液的浓度,标定时可采用甲基橙为指示剂
溶液的浓度,标定时可采用甲基橙为指示剂
D.选择甲基红指示反应终点,误差比甲基橙的小
【答案】C
【解析】
A. ![]() 与盐酸恰好完全反应时,生成NaCl为强酸强碱盐,溶液呈中性,溶液
与盐酸恰好完全反应时,生成NaCl为强酸强碱盐,溶液呈中性,溶液![]() ,A正确;
,A正确;
B. ![]() 盐酸物质的量为0.002mol,
盐酸物质的量为0.002mol,![]() 时,NaOH的物质的量为0.003mol,则反应后余下NaOH0.001mol,溶液体积为50ml,则NaOH的浓度为
时,NaOH的物质的量为0.003mol,则反应后余下NaOH0.001mol,溶液体积为50ml,则NaOH的浓度为![]() =0.02mol/L,则H+的浓度为
=0.02mol/L,则H+的浓度为![]() ,溶液
,溶液![]() ,B正确;
,B正确;
C.甲基橙的变色范围是3.1~4.4,甲基红的指示范围是4.4~6.2,二者差不多,相反甲基红的指示范围与突变范围重叠更大,更能降低误差,因此应该使用甲基红,C错误;
D. 根据突变范围选择合适的指示剂,要求指示剂的指色范围与突变范围有重叠,所以选择变色范围在pH突变范围内的指示剂,故甲基红指示反应终点,误差比甲基橙的小,D正确;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】煤燃烧排放的烟气含有SO2和NOx,大量排放烟气形成酸雨、污染大气,因此对烟气进行脱硫、脱硝,对环境保护有重要意义。回答下列问题:
Ⅰ.利用CO脱硫
(1)工业生产可利用CO气体从燃煤烟气中脱硫,则25℃时CO从燃煤烟气中脱硫的热化学方程式2CO(g)+SO2(g)2CO2(g)+S(s)的焓变△H=_____________。25℃,100kPa时,由元素最稳定的单质生成1mol纯化合物时的反应热称为标准摩尔生成焓,已知一些物质的“标准摩尔生成焓”如下表所示:
物质 | CO(g) | CO2(g) | SO2(g) |
标准摩尔生成焓fHm(25℃)/kJmol-1 | -110.5 | -393.5 | -296.8 |
(2)在模拟脱硫的实验中,向多个相同的体积恒为2L的密闭容器中分别通入2.2mol CO和1mol SO2气体,在不同条件下进行反应,体系总压强随时间的变化如图所示。
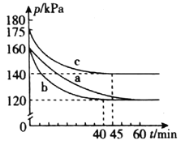
①在实验b中,40 min达到平衡,则0~40 min用SO2表示的平均反应速率v(SO2)=_______。
②与实验a相比,实验b可能改变的条件为_______________,实验c可能改变的条件为_________________。
Ⅱ.利用NH3脱硝
(3)在一定条件下,用NH3消除NO污染的反应原理为:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H=-1807.98kJ·mol-1。在刚性容器中,NH3与NO的物质的量之比分别为X、Y、Z(其中X<Y<Z),在不同温度条件下,得到NO脱除率(即NO转化率)曲线如图所示。
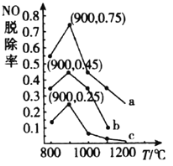
①NH3与NO的物质的量之比为X时对应的曲线为_____________(填“a”“b”或“c”)。
②各曲线中NO脱除率均先升高后降低的原因为__________。
③900℃条件下,设Z=![]() ,初始压强p0,则4NH3(g)+6NO(g)5N2(g)+6H2O(l)的平衡常数Kp=_____________(列出计算式即可)。
,初始压强p0,则4NH3(g)+6NO(g)5N2(g)+6H2O(l)的平衡常数Kp=_____________(列出计算式即可)。
Ⅲ.利用NaCIO2脱硫脱硝
(4)利用NaClO2的碱性溶液可吸收SO2和NO2(物质的量之比为1:1)的混合气体,自身转化为NaCl,则反应的离子方程式为________________。
【题目】一定温度下,在三个体积为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法不正确的是
A.该反应为放热反应
B.容器I达到平衡所需要的时间比容器Ⅲ短
C.达到平衡时,容器I中的CH3OH体积分数大于容器Ⅱ
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行