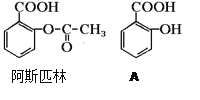
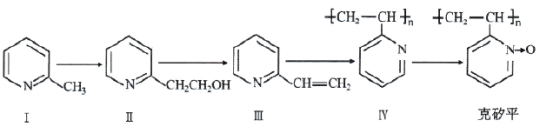
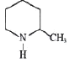
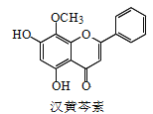
题目内容
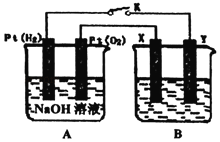
【题目】某化学兴趣小组用如图所示装置进行电化学原理的实验探究,冋答下列问题:
(1)通入O2的Pt电极为电池的_____(填“正极”或“负极”),电极反应式为_____。
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为_____(填“镀件”或“银”)。
(3)若B电池的电解质溶液为500mL1.0molL﹣1的NaCl溶液(滴有少量紫色石蕊试液),X、Y皆为惰性电极,电池工作过程中发现X极溶液先变红后局部褪色,解释原因_____。当电池工作一段时间后断开K,Y极共收集到560mL气体(标准状况),此时B池中溶液的pH=_____(假设溶液体积不变),转移电子的数目为_____。
【答案】正极 O2+4e﹣+2H2O=4OH﹣ 银 X电极产生的Cl2与水反应产生的HCl和HClO使溶液显酸性,同时HClO有漂白性 13 0.05NA
【解析】
在如图所示的装置中,A装置是燃料电池,A装置通入H2的电极为负极,通入O2的电极为正极;B装置是电解池,X与电源的正极相连,是阳极发生氧化反应,Y与电源的负极相连,是阴极发生还原反应。
(1) 在如图所示的装置中,A装置是燃料电池, B装置是电解池,其中对于A装置来说,通入O2的电极为正极,正极得到电子,发生还原反应,电极方程式为O2+4e-+2H2O=4OH-;
(2) X与电源的正极相连,是阳极发生氧化反应,所以X电极材料为银;
(3) X是阳极,发生反应:2Cl--2e-=Cl2↑,Cl2与水反应产生的HCl和HClO,使溶液显酸性石蕊变红,同时HClO有强氧化性使红色褪去,所以原因为:X电极产生的Cl2与水反应产生的HCl和HClO使溶液显酸性,同时HClO有漂白性;Y极生成氢气,n(H2)=![]() =0.025mol,根据电解总反应方程式:2NaCl+2H2O
=0.025mol,根据电解总反应方程式:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH可知:每产生1mol氢气,会同时产生2molNaOH,由于n(H2)=0.025mol,所以n(NaOH)=2×0.025mol=0.05mol,溶液的体积是500 mL,则c(NaOH)=
Cl2↑+H2↑+2NaOH可知:每产生1mol氢气,会同时产生2molNaOH,由于n(H2)=0.025mol,所以n(NaOH)=2×0.025mol=0.05mol,溶液的体积是500 mL,则c(NaOH)=![]() =0.1mol/L,所以pH=13;根据反应方程式生成的Cl2为0.025mol,结合2Cl--2e-=Cl2↑,则转移电子为2×0.025mol=0.05mol,数目为0.05NA。
=0.1mol/L,所以pH=13;根据反应方程式生成的Cl2为0.025mol,结合2Cl--2e-=Cl2↑,则转移电子为2×0.025mol=0.05mol,数目为0.05NA。

【题目】煤燃烧排放的烟气含有SO2和NOx,大量排放烟气形成酸雨、污染大气,因此对烟气进行脱硫、脱硝,对环境保护有重要意义。回答下列问题:
Ⅰ.利用CO脱硫
(1)工业生产可利用CO气体从燃煤烟气中脱硫,则25℃时CO从燃煤烟气中脱硫的热化学方程式2CO(g)+SO2(g)2CO2(g)+S(s)的焓变△H=_____________。25℃,100kPa时,由元素最稳定的单质生成1mol纯化合物时的反应热称为标准摩尔生成焓,已知一些物质的“标准摩尔生成焓”如下表所示:
物质 | CO(g) | CO2(g) | SO2(g) |
标准摩尔生成焓fHm(25℃)/kJmol-1 | -110.5 | -393.5 | -296.8 |
(2)在模拟脱硫的实验中,向多个相同的体积恒为2L的密闭容器中分别通入2.2mol CO和1mol SO2气体,在不同条件下进行反应,体系总压强随时间的变化如图所示。
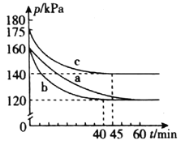
①在实验b中,40 min达到平衡,则0~40 min用SO2表示的平均反应速率v(SO2)=_______。
②与实验a相比,实验b可能改变的条件为_______________,实验c可能改变的条件为_________________。
Ⅱ.利用NH3脱硝
(3)在一定条件下,用NH3消除NO污染的反应原理为:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H=-1807.98kJ·mol-1。在刚性容器中,NH3与NO的物质的量之比分别为X、Y、Z(其中X<Y<Z),在不同温度条件下,得到NO脱除率(即NO转化率)曲线如图所示。
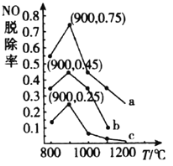
①NH3与NO的物质的量之比为X时对应的曲线为_____________(填“a”“b”或“c”)。
②各曲线中NO脱除率均先升高后降低的原因为__________。
③900℃条件下,设Z=![]() ,初始压强p0,则4NH3(g)+6NO(g)5N2(g)+6H2O(l)的平衡常数Kp=_____________(列出计算式即可)。
,初始压强p0,则4NH3(g)+6NO(g)5N2(g)+6H2O(l)的平衡常数Kp=_____________(列出计算式即可)。
Ⅲ.利用NaCIO2脱硫脱硝
(4)利用NaClO2的碱性溶液可吸收SO2和NO2(物质的量之比为1:1)的混合气体,自身转化为NaCl,则反应的离子方程式为________________。
【题目】一定温度下,在三个体积为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法不正确的是
A.该反应为放热反应
B.容器I达到平衡所需要的时间比容器Ⅲ短
C.达到平衡时,容器I中的CH3OH体积分数大于容器Ⅱ
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行