题目内容
10.现有Wg某不饱和链烃R(R分子中只含单键和双键),R能与VL(标准状况)氢气恰好完全反应,生成烷烃.若R的相对分子质量为M,阿伏加德罗常数为NA,则lmol R中含有双键数目为( )| A. | $\frac{WV{N}_{A}}{22.4M}$ | B. | $\frac{MV{N}_{A}}{22.4W}$ | C. | $\frac{WV}{22.4M}$ | D. | $\frac{MV}{22.4W}$ |
分析 根据碳碳双键与氢气发生加成时的物质的量之比为1:1,设双键的数目为x,不饱和烃的物质的量与x的乘积等于氢气的物质的量,以此来计算.
解答 解:设1mol R中含双键为x,
饱和烃的物质的量与x的乘积等于氢气的物质的量,
则$\frac{wg}{Mg/mol}×x=\frac{VL}{22.4L/mol}$,
解得x=$\frac{MV}{22.4w}$,则其数目为$\frac{MV{N}_{A}}{22.4w}$,故选B.
点评 本题考查学生利用不饱和烃与氢气加成的反应规律来进行计算,明确物质的量的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
20.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是( )
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$mol的1H35Cl分子所含中子数约为6.02×1023 | |
| C. | 气体35Cl2的摩尔质量为70 | |
| D. | 3.5g的气体35Cl2的体积为2.24L |
1.某化工废液中可能含有下列微粒:Al3+、Fe3+、NO2-、甘油分子.某化学兴趣小组的同学设计了下列实验验证这些微粒的存在,下列说法不正确的是( )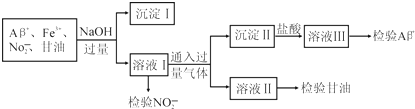
已知:Al3++6F-═[AlF6]3-.

已知:Al3++6F-═[AlF6]3-.
| A. | 通入的过量气体可能是CO2 | |
| B. | 分离出沉淀Ⅰ的操作名称是过滤,利用沉淀Ⅰ可检验出Fe3+ | |
| C. | 若向溶液Ⅲ中先加足量NH4F后再加氨水可以检验Al3+ | |
| D. | 用酸性KI溶液检验NO2-离子的离子方程式为2NO2-+2I-+4H+═2NO+I2+2H2O |
5.琥珀酸二乙酯的键线式结构如图所示;下列关于它的说法错误的是( )
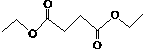

| A. | 该物质的化学式为C8H14O4 | |
| B. | 该物质不溶于水 | |
| C. | 琥珀酸是丁二酸 | |
| D. | 琥珀酸二乙酯与NaOH溶液反应,1 mol该物质可以得到2 mol乙醇和1 mol琥珀酸 |
15. “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )| A. | 遇FeCl3溶液发生显色反应 | |
| B. | 易发生氧化反应和取代反应 | |
| C. | 能与碳酸氢钠溶液反应放出CO2气体 | |
| D. | 1 mol EGC与4 mol NaOH恰好完全反应 |
2.25℃时,下列溶液中有关微粒的物质的量浓度关系错误的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| C. | 室温下pH=7的CH3COOH与CH3COONa的混合液中离子的浓度大小顺序为:c(Na+)=c(CHCOO-)>c(H+)=c(OH-) | |
| D. | pH=4的NaHA溶液:c(HA-)>c(H+)>c(H2A)>c(A2-) |
19.已知Br2在有机溶剂中的溶解度比在水中的大,下列有机溶剂能从溴水中萃取溴的是( )
| A. | 酒精 | B. | 乙酸 | C. | 四氯化碳 | D. | 汽油 |
9.下列各组中的三种微粒,所含质子数与电子数都相等的是( )
| A. | Na+、Mg2+、Al3+ | B. | HCl、H2S、Ar | C. | H2O、OH-、Na+ | D. | NH4+、Na+、F- |