题目内容
18.往AgNO3溶液中加入某浓度的盐酸(密度为1.12g/ml),至恰好沉淀完全,此时溶液的质量与原AgNO3溶液的质量相同,则此盐酸溶液的质量分数为25.4%,物质的量浓度为7.8mol/L.分析 发生反应:AgNO3+HCl=AgCl↓+NaNO3,所得溶液的质量与原AgNO3溶液的质量相同,AgCl质量等于盐酸质量,设AgCl的质量为143.5g,根据n=$\frac{m}{M}$计算AgCl物质的量,结合方程式计算n(HCl),根据m=nM计算HCl质量,进而计算盐酸质量分数,根据V=$\frac{m}{ρ}$计算盐酸的体积,再根据c=$\frac{n}{V}$计算盐酸物质的量浓度.
解答 解:发生反应:AgNO3+HCl=AgCl↓+NaNO3,所得溶液的质量与原AgNO3溶液的质量相同,AgCl质量等于盐酸质量,设AgCl的质量为143.5g,则AgCl物质的量1mol,结合方程式可知n(HCl)=n(AgCl)=1mol,故m(HCl)=1mol×36.5g/mol=36.5g,故盐酸溶液的质量分数为$\frac{36.5g}{143.5g}$×100%=25.4%;
盐酸的体积为$\frac{143.5g}{1120g/L}$=$\frac{143.5}{1120}$L,盐酸物质的量浓度为$\frac{1mol}{\frac{143.5}{1120}L}$=7.8mol/L,
故答案为:25.4%;7.8mol/L.
点评 本题考查化学方程式有关计算,关键是判断盐酸质量与AgCl质量相等,注意运用特殊值简化计算.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | X2+的核外电子数目为10,则X在第3周期第ⅡA族 |
9.下列关于卤素的叙述,正确的是( )
| A. | 单质的颜色随核电荷数的增加逐渐加深 | |
| B. | 卤化银的溶解度随核电荷数的增加逐渐增大 | |
| C. | 单质与水反应均可表示为X2+H2O═HX+HXO | |
| D. | 随核电荷数的增加,X-的半径递增,还原性递减 |
6.下列叙述中正确的是( )
| A. | 混合物中元素一定呈化合态 | |
| B. | 由一种元素组成的物质一定是单质 | |
| C. | 某纯净的物质不是化合物就是单质 | |
| D. | 由同种分子组成的物质一定是纯净物 |
13.下列说法不正确的是( )
| A. | 使用可再生能源,用超临界二氧化碳替代有机溶剂,注重原子经济性,采用低能耗生产工艺等都是绿色化学的内容 | |
| B. | 13C与14C属于同一种元素,它们互为同位素 | |
| C. | 通过化学变化可以实现235U与238U的相互转化 | |
| D. | 同位素示踪法是研究化学反应历程的手段之一 |
3.现代化学测定有机化合物结构的分析方法比较多,经常采用的是1H核磁共振(1H-NMR)、红外光谱(IR)等方法.在1H-NMR分析中,有机物分子中的氢原子核所处的化学环境(即附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置也就不同.下图1和图2是A、B两种物质的1H核磁共振氢谱.已知A、B两种物质都含有6个氢原子.请根据图1和图2两种物质的核磁共振氢谱图选择出不可能属于图1和图2的两种物质是( )
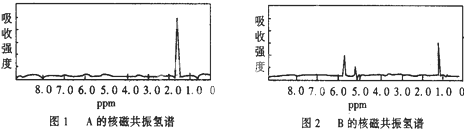

| A. | A是C3H6;B是C2H6 | B. | A是C2H6;B是C3H6 | ||
| C. | A是C2H6O;B是C3H6 | D. | A是C3H6;B是C2H6O |
10.现有Wg某不饱和链烃R(R分子中只含单键和双键),R能与VL(标准状况)氢气恰好完全反应,生成烷烃.若R的相对分子质量为M,阿伏加德罗常数为NA,则lmol R中含有双键数目为( )
| A. | $\frac{WV{N}_{A}}{22.4M}$ | B. | $\frac{MV{N}_{A}}{22.4W}$ | C. | $\frac{WV}{22.4M}$ | D. | $\frac{MV}{22.4W}$ |
7.最能说明镁的金属性比钙弱的事实是( )
| A. | 钙能与冷水反应,镁与热水反应 | |
| B. | 碳酸镁微溶于水,碳酸钙难溶于水 | |
| C. | 氢氧化镁难溶于水,氢氧化钙微溶于水 | |
| D. | 钙能置换氯化镁溶液中的镁 |
17.下表标出的是元素周期表的一部分元素,回答下列问题:
(1)表中用字母标出的14种元素中,化学性质最不活泼的是Ar(用元素符号表示,下同),金属性最强的是K,非金属性最强的是F常温下单质为液态的非金属元素是Br,属于过度元素的是M(该空用字母表示).
(2)B,F,C的气态氢化物中以PH3最不稳定(填化学式).
(3)除稀有气体外第三周期中原子半径最小的是Cl(填元素符号)
(4)写出I、H号元素最高价氧化物的对应水化物的化学式:Mg(OH)2和Al(OH)3.强弱顺序是Mg(OH)2>Al(OH)3.
| 1 | ||||||||||||||||||
| 2 | D | B | A | |||||||||||||||
| 3 | J | I | H | C | G | F | E | |||||||||||
| 4 | L | K | M | N | ||||||||||||||
(2)B,F,C的气态氢化物中以PH3最不稳定(填化学式).
(3)除稀有气体外第三周期中原子半径最小的是Cl(填元素符号)
(4)写出I、H号元素最高价氧化物的对应水化物的化学式:Mg(OH)2和Al(OH)3.强弱顺序是Mg(OH)2>Al(OH)3.