题目内容
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-,现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。以下推测错误的是
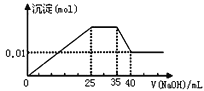
A.原溶液一定不存在H+、Cu2+、CO32-
B.不能确定原溶液是否含有K+、NO3-
C.原溶液中n(Mg2+):n(Al3+):n(NH4+)=1∶1∶2
D.实验所加的NaOH溶液浓度为2mol/L
【答案】B
【解析】
无色溶液,不含铜离子,逐滴滴加NaOH溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3H2O,说明含有铵根离子,最后溶液中有沉淀,说明溶液中含Mg2+,镁离子和碳酸根离子不共存,所以溶液中一定不含碳酸根离子,由此分析解答。
A.原溶液一定不存在H+、Cu2+、CO32,故A正确;
B.不含碳酸根离子,根据溶液呈电中性,所以一定含硝酸根离子,故B错误;
C.根据图象知,3540mL时Al(OH)3和NaOH反应生成NaAlO2,则025mL时NaOH和Mg2+、Al3+反应生成沉淀,生成NaAlO2时需要NaOH5mL,则生成Al(OH)3需要NaOH15mL,则有10mLNaOH溶液和镁离子反应,2535mL时氢氧化钠溶液和NH4+反应生成氨水,根据使用NaOH溶液体积知,n(Mg2+):n(Al3+):n(NH4+)=1:1:2,故C正确;
D.当加入40mLNaOH溶液时,剩余的沉淀是Mg(OH)2,n(Mg(OH)2)=0.01mol,根据原子守恒知,n(Mg2+)=0.01mol,c(Mg2+)=0.01mol/0.1L=0.1mol/L,生成0.01molMg(OH)2需要n(NaOH)是0.02mol,Al(OH)3和NaOH反应生成NaAlO2,需要NaOH溶液的体积是5mL,则铝离子和NaOH溶液反应生成Al(OH)3沉淀时需要NaOH溶液的体积是15mL,则生成氢氧化镁需要NaOH溶液的体积是10mL,所以c(NaOH)=![]() =2mol/L,故D正确;
=2mol/L,故D正确;
答案选B。

【题目】下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)单质化学性质最不活泼的是___;
(2)地壳中含量最多的元素是___(填名称);
(3)单质常用作半导体材料的是___;
(4)Mg原子结构示意图为___;
(5)O和S中,原子半径较大的是___;
(6)CH4和NH3中,热稳定性较强的是___(填名称);
(7)新制氯水有漂白作用,是因为其中含有___(填“HCl”或“HClO”);
(8)元素最高价氧化物对应水化物中,碱性最强的是___(填化学式),两性氢氧化物是___;
(9)某烃分子中含有6个碳原子,结构简式为![]() ,常用作有机溶剂。该有机物分子式为___,其中碳元素与氢元素的质量比m(C):m(H)=___(相对原子质量:H-1 C-12)
,常用作有机溶剂。该有机物分子式为___,其中碳元素与氢元素的质量比m(C):m(H)=___(相对原子质量:H-1 C-12)