题目内容
【题目】下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)单质化学性质最不活泼的是___;
(2)地壳中含量最多的元素是___(填名称);
(3)单质常用作半导体材料的是___;
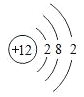
(4)Mg原子结构示意图为___;
(5)O和S中,原子半径较大的是___;
(6)CH4和NH3中,热稳定性较强的是___(填名称);
(7)新制氯水有漂白作用,是因为其中含有___(填“HCl”或“HClO”);
(8)元素最高价氧化物对应水化物中,碱性最强的是___(填化学式),两性氢氧化物是___;
(9)某烃分子中含有6个碳原子,结构简式为![]() ,常用作有机溶剂。该有机物分子式为___,其中碳元素与氢元素的质量比m(C):m(H)=___(相对原子质量:H-1 C-12)
,常用作有机溶剂。该有机物分子式为___,其中碳元素与氢元素的质量比m(C):m(H)=___(相对原子质量:H-1 C-12)
【答案】![]() 氧
氧 ![]()
 硫 氨气
硫 氨气 ![]()
![]()
![]()
![]() 12:1
12:1
【解析】
(1)稀有气体的化学性质非常不活泼,几乎不跟任何物质发生反应,图中只有![]() 一种稀有气体;
一种稀有气体;
(2)地壳中含量最多的元素是氧,含量最多的金属元素是铝;
(3)在金属元素和非金属元素的交界处是半导体元素,图中只有![]() 元素;
元素;
(4)镁是12号元素,核内有12个质子,核外有12个电子,画出其原子结构示意图 即可;
即可;
(5)氧和硫是同主族元素,同主族元素原子序数越大半径越大,因此硫原子的半径大于氧原子;
(6)根据元素周期律,非金属性越强的元素,其气态氢化物的稳定性越强,氮元素的非金属性强于碳,因此氨气的稳定性较强;
(7)新制氯水中因含有![]() 而具有漂白性,盐酸无论浓稀均无漂白性;
而具有漂白性,盐酸无论浓稀均无漂白性;
(8)金属性越强的元素,其最高价氧化物对应的水化物的碱性越强,图中金属性最强的是钠元素,故填![]() ;而铝和铍对角线相似,其氢氧化物均具有两性,图中无铍,填
;而铝和铍对角线相似,其氢氧化物均具有两性,图中无铍,填![]() 即可;
即可;
(9)图中为结构简式,只画出了碳原子,根据每个碳原子必定形成4个共价键的原则,将不足的化学键用氢补上,可以得出其分子式为![]() ;既然碳和氢各6个,它们的质量比就是单个碳原子和氢原子的质量比,即12:1。
;既然碳和氢各6个,它们的质量比就是单个碳原子和氢原子的质量比,即12:1。